
CROI 2015, Seattle, USA, du 24 au 26 février - La chronique du COREVIH-Bretagne, financée à 100% par l'état français ! (avec des vrais morceaux d'argent public dedans)
 La chronique de la CROI 2015 est terminée ! La chronique de la CROI 2015 est terminée !
Comme chaque année, difficile de choisir entre les sessions - pour cette dernière journée, choix cornélien entre le VHC et les comorbidités - mais il existe de nombreux autres compte-rendus francophones sur le net : si la chronique vous donne envie d'aller voir une session de façon plus détaillée, vous avez accès à tous les webcast de la conférence ICI. Ne pas rater non plus les comptes-rendus de la lettre de l'infectiologue réalisés par Gilles Pialoux et son équipe de rédaction sur place ICI (très belles diapositives), ainsi que les comptes rendus en français du réseau AIDSMAP ICI.
Le programme de la CROI 2015 (PDF) est disponible ici et le livre comprenant tous les résumés (attention PDF volumineux de 16 Mo) ICI
Bonne lecture... et rendez-vous pour le compte-rendu de l'IAS 2015 à Vancouver, du 18 au 23 juillet (de la lecture sérieuse avant de partir en vacances en perspective).
Dr Cédric Arvieux
Jeudi 26 février 2015
Avec la PrEP, le VHC a été la seconde star de la CROI-2015. Tous les essais vont dans le même sens : comme chez les patients mono-infectés par le VHC, les nouveaux traitements du VHC d'action directe chez les co-infectés (DAA) sont TROP ! Trop efficaces, trop bien tolérés, trop faciles à prendre (98% d'efficacité dans un essai avec un seul comprimé par jour pendant 12 semaines) et surtout TROP CHERS !! Voir la session de communication orale de ce jeudi matin un peu plus bas...
Séssion plénière - matin
Maladie cardiovasculaire chez les patients infectés par le VIH : un défi émergeant nécessitant d’engager des actions – Steven Greespoon – Harvard, USA
Alors que la mortalité infectieuse du VIH diminue au fil du temps, la mortalité cardiovasculaire augmente proportionnellement, et la physiopathologie de cette surmortalité n’est pas encore complétement connue. Toutes les études de cohortes comparant VIH et non-VIH montrent que le risque cardiovasculaire (RCV) est franchement majoré chez les patients VIH+, de l’ordre de 50%, même quand on ajuste sur les facteurs classiques que sont le tabac, le score de Framingham, l’activité physique etc…
Le paradigme des traitements est également à prendre en considération, les anciens traitements ayant un eu un impact important sur des paramètres affectant mortalité CV, mais « paradoxalement » trouvant une mortalité CV moindre chez les patients traités par rapport aux non traités.
Il y a donc très probablement une responsabilité intrinsèque du virus qui n’a pas encore été complétement élucidée. Dans des travaux expérimentaux comparant traitement précoce de la primo-infection versus à S12, le fait de traiter tôt améliore considérablement l’efflux de cholestérol, qui est un facteur anti-athérogène majeur. Il existe par ailleurs une relation assez linéaire entre le nadir de CD4, ou la durée de l’immunodépression, sur l’incidence des différents évènements cardiovasculaire (IDM, AVC…). Toutes ces constations plaident pour un rôle direct du VIH, et d’un rôle associé de l’inflammation accrue liée au déficit immunitaire, qui n’est pas une spécificité du VIH.
Des études récentes chez les patients VIH+ sans maladies CV connue, montrent qu’il existe des plaques d’athérosclérose inflammatoires, non calcifiées (et donc vulnérables) et associées à des marqueurs de l’inflammation à leur surface. Ce ne sont pas les mêmes plaques que l’on retrouve chez les patients non-infectés par le VIH, qui se constituent selon des mécanismes différents (plaques qui sont, notamment, calcifiées).
L’activation immune est un facteur majeur, notamment macrophagique et monocytaire, pour l’instabilité de la plaque athéromateuse. Ce sont le plus souvent les plaques non-calcifiées qui montrent une inflammation spécifique chez les patients VIH+. Quelle est la signification d’avoir des plaques « à haut-risque » ? Dans la population non-VIH, cela est très corrélé à la morbi-mortalité CV, les études spécifiques dans la population VIH+ n’ont pas encore été menées.
Concernant la prise en charge thérapeutique de ces anomalies, aujourd’hui, les patients VIH+ ne rentreraient pas pour la plupart dans les recommandations de mise sous statines : dans une étude récente de prévalence des anomalies CV, 75% des patients VIH+ avec des plaques à haut risque ne rentreraient pas dans les recommandations de mise sous statine (Zanni et al . AIDS 2014).
Les moyens traditionnels ne doivent pas être négligés (limités HTA, consommation de tabac, luter contre l’hyperlipidémie, introduction de l’aspirine si nécessaire…), mais les statines ont un effet anti-inflammatoire spécifique qui pourrait être bénéfique aux patients VIH+. De nombreuses études observationnelles vont dans le sens d’une bonne tolérance des statines chez les patients VIH+ (mais néanmoins moins bonne que chez les VIH-), et d’un effet sur la morbi-mortalité CV. Mais il n’existait jusqu’à aujourd’hui aucun essai randomisé contrôlé s’intéressant à la question : un essai (REPRIEVE) va débuter chez 6 500 patients VIH + de faible risque CV, avec une randomisation pitavastatine versus placebo. L’objectif est la réduction des évènements cardiovasculaires sur le long terme.
(NDR : La partie physiopathologique de cet exposé est très riche en iconographie et je vous conseille, si vous êtes intéressé par le sujet, de regarder le webcast correspondant. L’exposé a été un long plaidoyer pour l’utilisation des statines chez les patients infectés par le VIH… on attend donc les résultats des essais randomisés !)
Le prix du travail du sexe : infection par le VIH chez les travailleuses du sexe, contexte et réponse de santé publique – Frances M. Cowan – Zimbabwe
La prévalence de la prostitution féminine va de 0,1 à 9,1% à travers le monde, en fonction des continent et des sous-régions OMS. Une méta-analyse de la banque mondiale de 2012 retrouve une prévalence du VIH dans cette population qui va de 12% (Afrique) à 30% (Asie).
Les prostituées sont 13,5 fois plus à risque de VIH que la population générale (Baral et al. Lancet 2013). Il est probable que la plupart des études d’incidence sous-estiment le nombre de nouvelles infections VIH attribuables à la prostitution (Mishra et al. Sex trans 2014, Boily et al. JAIDS 2014). L’une des questions qui se pose est de savoir si les programmes de diminution d’incidence du VIH chez les travailleuses du sexe asiatique peuvent être extrapolés en Afrique, afin d’éviter que l’incidence ne continue à se stabiliser dans cette population.
L’influence des déterminants structurels sur la diffusion du VIH dans cette population est importante : une diminution de la criminalisation du travail du sexe pourrait avoir une efficacité importante (-33 à -46% d’incidence dans les modèles) de même que la diminution des violences sexuelles (de - 17 à -20%). A titre d’exemple l’oratrice a cité un officier de Police de Lagos pour illustrer la marge de travail à accompir : « Pouvoir violer les prostituées est l’un des rares bénéfices secondaires des patrouilles nocturnes à Lagos ; nous utilisons cet argument pour recruter des volontaires pour les patrouilles nocturnes ».
L’oratrice distingue 6 niveaux où la prévention peut intervenir : au niveau « environnemental » (ex : abolition des lois criminalisant la prostitution), politiques publiques (ex : campagnes de lutte conte les violences sexuelles), communautés (Ex : favoriser le changement de comportement pour que les travailleuses du sexe ne soient plus perçues comme des parias), les pairs (mais l’intense lutte entre les prostituées pour atteindre les clients limite souvent les actions dans ce domaine) et individuels (utilisation du préservatif, de la PrEP etc).
De nouveaux types d’interventions préventives pourraient être programmées : les recherches sur la PrEP recrutent relativement peu de travailleuses du sexe, alors qu’elles seraient très probablement hautement bénéficiaires de cette stratégie ; les (rares) recherches spécifiques aux travailleuses du sexe montrent que l’on a relativement peu de différence d’adhésion, de perdues de vue que dans la population générale. Une analyse regroupant 4 études semi-récentes montre l’obtention d’une CV indétectable dans 58% des cas dans cette population en Afrique. Il est probable que la population des travailleuses du sexe soit celle qui puisse le mieux bénéficier de prévention combinée (préservatif, gel de TDF, PrEP orale) mais cela est encore mal étudié en dehors de modèles épidémiologiques.
L’analyse du programme « Sisters » du Zimbabwe (13 000 prostituées participent au programme) montre qu’au fil du temps (entre 2009 et 2014) la non-connaissance du statut VIH diminue (de 40 à 22%) et la proportion de prostituées connaissant leur statut et sous traitement ARV augmente. Ce programme a permis de faire entrer dans le soin un nombre important de prostituées, avec une « cascade de prise en charge » en nette amélioration (60% des séropositives dépistées, 40% de l’ensemble des séropositives sous traitement et 75% de ces dernières avec une CV indétectable (soit 33% du total des prostituées VIH+ connue ou inconnue qui pourraient être captée par le programme). Dans l’ensemble des études rapportées, un élément revient sans cesse : plus les travailleuses du sexe sont jeunes, plus la prise de risque est élevée, moins l’adhésion aux programmes de prévention est bonne et plus les indicateurs de santé sont mauvais. Comme beaucoup de femmes africaines s’engagent très jeunes dans le travail du sexe, cela nécessiterait des études spécifiques…
Le Webcast de cette session est disponible ICI
Session de communication orale - Matin : Guérir l'infection à VHC : Mission accomplie !
L’importance de l’atteinte hépatique chez les personnes infectées par le VHC vivant aux Etats-Unis - Monina Klevens (USA, Abs 145)
Les CDC américains ont définis un accès aux nouveaux traitements du VHC selon des règles proches de celles qui sont appliquées en France (Metavir F3 et F4). Mais on ne connaît pas bien la prévalence de ces anomalies aux USA : l’objectif de l’étude est d’évaluer le degré de fibrose à partir du score FIB-4, qui est simple à calculer (âge, asat, alat, plaquettes) (on peut le retrouver ici) et très corrélé à la fibrose dans le contexte des hépatites C. Il peut être extrait de bases de données déjà existantes.
Dans la base utilisée, 9 785 956 dossiers de patients sont disponibles, 86 000 patients disposent de l’ensemble des paramètre permettant de cibler la population qui nous intéresse (disposer de l’âge, connaître l’ARN VHC etc…) et permettant de faire le calcul de score. Trois tranches d’âge ont été étudiées : personnes nées <1945, > 1965 ou entre les deux. Le résultat est éloquent : la moitié des patients ARN VHC+ qui sont nés entre 1945-65 ont une cirrhose ou une fibrose sévère, et de tous ceux qui ont une cirrhose/fibrose, plus de 80% sont nés en 1945-65.
Haute efficacité de l’association Daclatasvir/Asunaprevir/Peg-RBV chez les patients infectés par le VIH et le VHC de génotype 1 ou 4, et antérieurement Null Responders (ANRS HC30) - Lionel Piroth, (France, Abs 146)
De nombreux patients en France sont infectés par un VHC de génotype 1 ou 4. L’essai ANRS HC30 QUADRIH teste l’association Daclatasvir/Asunaprevir/Peg-IFN/ribavirine chez les patients co-infectés par le VIH, sous traitement ARV à base de raltegravir. Ce traitement était précédé d’une phase de lead-in de 12 semaines d’interféron et ribavirine.
Soixante quinze patients ont été inclus, dont 27 avaient une cirrhose, la moyenne de l’élastométrie était de 9,2 kPa.
Les patients étaient peu immunodéprimés (770 CD4 en moyenne) et l’infection VHC était ancienne (moyenne : 16 ans).
La SVR 12 est de 94,6 et 97,4 % (Génotype 1 et 4), y compris dans les cirrhoses (> 90%). Les non-cirrhotiques de génotype 4 pètent le score à 100% de succès.
Deux patients sont en échec et présentent une résistantes NS3 et NS5A, après une phase de charge virale indétectable, ce qui plaide plus pour une efficacité insuffisante que pour inobservance, mais les paramètres pharmacologiques des patients en échecs seront bientôt analysés pour confirmation.
La plupart des effets secondaires sont hématologiques (5% d’arrêt pour effet secondaire). Il y a un décès d’infection sévère chez une patiente cirrhotique. Il n’y a pas d’impact sur l’infection par le VIH.
La question cruciale est de savoir si la part IFN/RBV est indispensable, et si la phase de lead-in est également indispensable : a posteriori, on ne ferait pas de lead-in aujourd’hui.
Haut niveau de SVR indépendant de l’obtention d’une charge virale indétectable avec l’association Paritaprevir/r/Ombitasvir et Dasabuvir + RBV - David Wyles (USA, Abs 147)
L’idée est de regarder si les patients co-infectés par le VIH ont une charge virale VHC qui diminue aussi vite que chez les mono-infectés, sous traitement par Paritaprevir/r, Ombitasvir et Dasabuvir+RBV. L’analyse poolée de plusieurs études permet d’analyser 2 053 patients (dont 19% ont une cirrhose).
Il n’y a pas de différence statistiquement significative entre VIH et non-VIH pour atteindre une charge virale VHC <25 UI et <15UI (NDR : les courbes montrent même un petit avantage pour la co-infection !). La SVR12 dans l’ensemble des études se situent entre 92 et 100%... Il n’y a pas de différence lorsque l’on regarde les résultats sur la race, le sexe, le phénotype IL28 ou les CD4 (mais seulement 7 patients avec des CD4 <350 sur les 2 000…). Les patients ayant une CV VHC très élevée négativent leur CV un peu plus tard que les autres, mais cela n’a pas d’impact sur la SVR12 (une partie des résultats ont été publiés dans le JAMA cette semaine).
Coûts pharmaceutique rapporté à la SVR, en utilisation de routine chez les patients traités par Simeprevir/Sofosbuvir +/- Ribavirine - Kian Bichoupan (USA, Abs 149)
Les essais récents montrant une très haute efficacité des traitements de l’infection par le VHC, il est important aujourd’hui de se poser la question l’aspect cout-efficacité en utilisation réelle de ces molécules (hors protocole de recherche).
L’objectif de cette étude est de calculer la partie « coût » d’une traitement d’infection VHC avec les nouveaux traitements, dans une cohorte rétrospective de patients du Mont Sinai Hospital. Le calcul du coût par SVR a été réalisé en divisant le coût de l’ensemble des traitements par le nombre de SVR obtenues : 202 patients ont initié SMV/SOF +/- RBV, avec 173 patients ayant été suivis jusqu’au bout et présentant l’analyse per-protocole.
La SVR est de 88%, identique avec et sans RBV. Le coût moyen par SVR est de 171 145 €, avec peu de différence (3 000€) avec et sans RBV (les patients sous RBV avaient plus souvent été en échec antérieurs, notamment d’antiprotéases). Le coût des molécules anti-VHC à action directe représente quasiment 95% des dépenses… Le coût de la prise en charge des effets secondaires est assez faible, et en partie attribuable à la RBV (correction des anémies par érythropoïétine).
Ces coûts ne prennent pas en compte ce que le patient aurait pu dépenser de son côté ou le coût lié aux arrêts de travail pour le suivi, par ailleurs le calcul est fait sur la base du prix affiché qui n’est pas nécessairement le prix payés par les fournisseurs de soins.
(suite à la séance de question, le coût en intention de traiter est de 199 000 $, si l’on inclus les patients perdus de vue etc ...).
Modélisation de l’effet du retardement de la mise sous traitement sur les évènements hépatiques des patients co-infectés VHC/VIH de la cohorte Suisse - Cindy Zahnd (Suisse, Abs 150)
Le coût des traitements de l’infection VHC fait que l’on ne traite pas tous les patients infectés par le VHC, alors que les données d’efficacité et de sécurité plaideraient pour un traitement universel. Un modèle de simulation a été développé chez les patients co-infectés, en tablant, à partir de la littérature, sur une diminution de la fibrose d’un facteur 10, des décompensations hépatiques d’un facteur 10, et de l’émergence d’un cancer d’un facteur 2.6 après la mise sous traitement.
Ce modèle a été appliqué aux patients de la cohorte Suisse.
En l’absence d’intervention, dans le modèle, 10% des patients au cours de leur vie ont une décompensation hépatique, 17% ont un cancer et 30% décèdent des complications du VHC.
Ces chiffres sont réduits à moins de 3% de décès de complication hépatique si on traite entre un mois et un an après le diagnostic. Le fait de différer le traitement de F2 à F3 fait augmenter la mortalité hépatique de 50% (10% versus 5% tout au cours de la vie). Dans ce modèle, les patients traités en F3 ou F4 meurent de complications hépatiques, mais guérissent virologiquement de leur VHC…
Enfin, si on attend le stade F4 versus un traitement rapide, la période de contagiosité des patients au cours de leur vie est augmentée d’un facteur 4.
Daclatasvir combiné au Sofosbuvir dans la co-infection VIH/VHC, Essai ALLY-2 - David Wyles1 (USA, Abs 151LB)
On sait déjà que l’association daclatasvir/sofosbuvir est très efficace chez les patients mono-infectés par le VHC. Ces deux molécules ont un faible potentiel d’interactions pharmacologiques : 203 patients co-infectés VIH/VHC, quelque soit le génotype, ont été inclus, avec une randomisation 8 ou 12 semaines chez les patients naïfs de traitement anti-HCV, et 12 semaines chez les patients antérieurement traités (tout produits, y compris sofosbuvir antérieur).
La grande majorité des patients étaient traités pour l’infection par le VIH, avec des régimes variés (EFV, DRV, RAL, DTG, NVP, RLP…).
On retrouve 76% de SVR 12 chez le patients traités 8 semaines, 96/98% chez les patients traités 12 semaines naïfs/ prétraités. On obtient 100% de SVR12 chez les patients ayant une charge virale VHC < 2.106 dans le groupe 8 semaines ! Il n’y a pas d’impact du génotype sur la SVR (100% de réponse pour les génotypes 2, 3 et 4), non plus que de la présence d’une cirrhose (10% des patients de l’étude).
Les patients en échec, essentiellement dans le bras 8 semaines, présentent au moment du rebond le plus souvent une résistance NS5A mais jamais NS5B. A noter qu’il semble y avoir plus d’échecs chez les patients sous darunavir, qui ont de fait été traités avec une dose réduite de daclatasvir à 30 mg/j.
Un décès d'origine cardiovasculaire chez un patient, 4 semaines après l’arrêt du traitement.
Traitement de 12 semaines par Ledipasvir/sofosbuvir chez les patients co-infectés VIH-1/VHC - Susanna Naggie (Canada, Abs 152LB)
Cette étude (ION-4) analyse l’efficacité de l’association Ledipasvir/Sofosbuvir (en monocomprimé journalier) chez les patients co-infectés, et a recruté 335 patients. Les patients devaient avoir une infection VIH contrôlée, pas d’insuffisance rénale, des plaquettes > 50 000. L’âge moyen de patients était de 52 ans, les CD4 étaient de 628/mm3, 20% avaient une cirrhose, 55% avaient déjà été traités et 34% étaient noirs : 96% des patients ont une SVR12. Dans l’analyse multivariée, seul le fait d’être noir est prédictif de l’échec… cette différence (10/13 échecs sont noirs) n’avait pas été retrouvée dans les essais ION antérieurs, chez des patients mono-infectés. Les données pharmacologiques ne sont pas différentes entre les noirs et les non-noirs et des analyses complémentaires sont en cours pour comprendre ces résultats.
La tolérance globale est bonne, 4% d’effets secondaires de grade 3-4. Ils sont identiques à ce que l’on retrouvait chez les mono-infectés. Il n’y a pas de modification moyenne de la créatinine, mais deux patients ont eu soit une réduction de la dose de TDF, soit un remplacement du TDF par une autre molécule du fait d’une augmentation de la créatinine > 0,4 mg/L.
Et encore de l'hépaite C pour le dessert ! Dernière session de jeudi après-midi « Hépatite C, nouvelles frontières et controverses »
Pathogénie de l’infection VHC aigüe – Ashwin Balogopal – USA
L’infection VHC aigüe est de plus en plus souvent diagnostiquée aux USA à ce stade, et l’on constate une diminution progressive de l’infection des infection VHC chez les usagers de drogues et une augmentation chez les MSM.
L’hépatite aigüe commence par la transmission d’une petite quantité de virions (de l’ordre de 4 pour établir une primo-infection), mais la multiplication est très rapidement majeure pour arriver rapidement à plusieurs millions de copies de virus : 20-45% des hépatocytes se retrouvent infectés, soit 20-43 milliards d’hépatocytes infectés… avec 1-100 copies de virus par hépatocytes, la charge virale hépatocytaire fait que… 1 à 3 trillions de copies de RNA sont fabriqués tous les jours. De 20 à 25% des patients vont guérir spontanément de leur infection VHC aigüe, ce qui laisse à penser qu’un jour une stratégie de vaccination sera peut être efficace : le fait d’être une femme , une personne non infectée par le VIH, un blanc, et le fait d’avoir déjà guéri antérieurement d’une hépatite C sont les principaux facteurs associés à la guérison spontanée. Le locus de l’interferon lambda est également un facteur essentiel (L. Prokuninna-Olson et al. Nature genetics 2013, A. McFarland et al. Nature immunology 2014). Les cellules NK jouent également un rôle : les cellules NK de personnes ayant guéri d’une hépatite C sont plus à même de diminuer la production d’ARN VHC. Enfin, des Ac neutralisants produits au moment de la guérison ont la capacité de neutraliser plus de variants (L. Liu et al. Hepatology 2012). La réponse CD8 diminue au fil du temps (en exprimant initialement la production d’IFNg, qui va diminuer au fil du temps). Ici aussi, chez des patients ayant guéri de l’infection VIH, les CD8 peuvent être capables de contrôler l’infection VHC. La réponse CD4 diminue également au fil du temps chez les patients infectés chroniquement. Tous ces éléments expliquent les constations cliniques : la race sur le phénotype IFN, le VIH sur les CD4 et CD8, sur les Ac neutralisants, le genre sur les CD8, CD4, les Ac neutralisants et cellules NK.
(NDR : cet exposé sur la physiopathologie de l’infection par le VHC était extrêmement didactique et clair – pour un non spécialiste du VHC – et on conseille donc vivement la consultation du Webcast pour ceux qui sont passionnés par le sujet).
Le traitement du VHC comme prévention – Greg Dore, Australie
On peut opposer trois conceptions de santé publique dans la lutte contre les agents infectieux : éradication (comme pour la variole, probable seul succès actuel de cette catégorie), élimination et contrôle…
Les modèles indiquent que l’élimination de l’hépatite C est un objectif que l’on pourraient atteindre (mais pas l’éradication). Dans un modèle de traitement des UD (Usagers de drogue) australiens, la mise sous traitement de 80% des UD amènerait une élimination du VHC en 2027 dans cette population ; mais le même modèle appliqué à Vancouver, du fait d’un beaucoup plus important pourcentage de personnes atteintes aujourd’hui, n’amènerait l’élimination que beaucoup plus tard, voire pas du tout…
Un défi est celui du dépistage, certains pays ayant pour l’instant très peu dépisté leurs infections VHC (L’Australie, la Suède et la France sont dans le peloton de tête des meilleurs dépisteurs). Les politiques de prévention chez les UD ont amené une forte diminution de l’incidence du VHC de 30% en 2003 à moins de 5% en 2009 en Australie , mais il faut essayer d’aller plus loin.
Si l’on s’intéresse spécifiquement au concept de traitement comme prévention, il faut cibler les populations à risque de transmission (prisonniers, usagers de drogue actifs ou substitués, MSM), pas les baby-boomers (qui sont pourtant une des plus grosses « charges » en terme de nombre de personnes infectées, mais qui transmettent pas ou peu).
Les prisonniers sont une population cible intéressante pour savoir si l’on peut diminuer l’incidence en traitant les personnes infectées, et l’étude STOPC est en cours dans les prisons australiennes, qui comprend une politique de réduction de risque et de traitement par bithérapie des personnes infectées, en débutant par les prisons à haut niveau de sécurité (NDR : l’équivalent de nos centrales), puis par les prisons de moyenne sécurité (l‘équivalent de nos maisons d’arrêt). Cette étude devrait permettre d’abord de caractériser l’incidence dans les prisons, puis de mesurer l’effet de l’intervention (traitement des personnes infectées) sur l’incidence ultérieure, selon un schéma assez complexe. L’ensemble de cette étude devrait permettre de modéliser le coût-efficacité d’une telle opération.
Un autre projet (CEASE) s’intéresse à la population co-infectée VIH-VHC, essentiellement MSM, avec des volets modélisation, bases de données, éducation et traitement dans la région de Sydney, afin la aussi de calculer l’incidence puis de mettre en place une stratégie de traitement et de mesurer l’effet TasP.
Qui faut-il cibler au sein d’une population d’usager de drogue ? Plus on traite tôt et mieux on fait en terme de diminution de risque de transmission (bénéfice collectif), mais c’est la population la plus âgée qui est le plus a risque de complication du VHC (bénéfice individuel)… qui choisir entre les deux ?
Du point de vue éthique, il y a des progrès à faire ! Dans l’Illinois, le fait de prendre un traitement de substitution est un critère d’exclusion pour la prescription des DAA !! Dans l’Oregon, il ne faut ni être consommateur d’alcool, ni d’aucune drogue pour pouvoir être traité (NDR : ce sujet sera largement abordé dans la dernière intervertion de la session, cf. ci-dessous).
VHC : c’est le virus, bien sûr ! – Mark Sukolwski – USA
Le VHC présente de multiples cibles potentielles de traitements antiviraux, et c’est l’étude de ces cibles qui nous a amenés où nous sommes aujourd’hui dans le succès des DAA. Les régimes aujourd’hui recommandés ciblent plusieurs zones virales, essentiellement NS3, NS5A, NS5B. Les inhibiteurs de la protéase (NS3) comme les inhibiteurs de NS5A sont individuellement inducteurs de résistances virales, et ces résistances sont le plus souvent croisées. C’est l’association des deux classes (Daclatasvir plus asunaprevir dans le tout premier essai) qui a pour la première fois permis d’obtenir une guérison chez des patients sans Interféron, mais quelques résistances pouvaient émerger avec cette combinaison. Les inhibiteurs de la NS5B ont une activité intrinsèque puissante qui permet encore d’augmenter les taux de guérison, mais les patients antérieurement en échec complet (répondeurs nuls) sont plus souvent en échec des DAA que les autres, et dans ces cas la Ribavirine paraît importante pour prévenir l’émergence de variants résistants dans un certain nombre de régimes.
Le Sofosbuvir (SOF) est la première molécule, qui, utilisée en monothérapie pendant 14 jours, n’induit pas d’émergence de variants résistants, et l’adjonction de Ledipasvir (LED) amène la quasi élimination de l’émergence de variants résistants sur le long terme, avec près de 100% de bonne réponses… Un patient en échec de LED/SOF avec résistance multiple, retraité avec les mêmes molécules+RBV pendant 24 semaines a finalement guéri…
Les seuls patients pour lesquels aujourd’hui on n’obtient pas de résultats aussi bons sont ceux qui sont infectés par un génotype 3 et ayant déjà une cirrhose. Mais de nouveaux traitements sont encore en cours de développement, et devraient arriver à régler la question : l’efficacité de la combinaison Sofosbuvir/ GS5816 ne semble pas être influencée par le génotype et donner de tout aussi bons résultats (NDR : pour mémoire, il y a plus de 53 millions de personnes dans le monde infectées par un VHC de génotype 2).
Et pour terminer, des traitements de plus en plus courts sont testés, avec un objectif d’aller pour certains patients vers des traitements de 4 semaines, avec des stratégies de retraitement pour ceux qui seraient en échec (NDR : ces stratégies de réduction de durée n’ont de sens que du fait du coût très élevé des traitements, car 4, 8 ou 12 semaines de traitements parfaitement tolérés n’a finalement que peu d’importance, et ceci a été soulevé lors de la discussion). Le « perfectovir », le médicament parfait guérissant tout le monde en peu de temps est à notre portée… mais on est encore loin de pouvoir faire à ce que les patients qui en ont besoin puissent en bénéficier, pour des raisons de coûts, mais pour également pour des raisons d’insuffisance de dépistage et de prise en charge.
HCV Therapeutics : big sticks with big stickers – M.G. Peters, USA
(NDR : Le titre de ce tout dernier topo de la CROI 2015 est intraduisible, un peu d’indulgence, merci…)
Actuellement les prévalences du VHC les plus importantes se situent en Chine, Inde, Egypte, Pakistan… Aux USA, les projections épidémiologique montrent que la mortalité liée au VHC va augmenter de façon progressive et majeure jusqu’au milieu du siècle avec un pic vers 2040, puis une diminution progressive et il faudra 60 ans au moins pour arriver de nouveau aux taux de mortalité et de morbidité actuels liés au VHC si l’on ne fait rien (car l’incidence baisse progressivement, indépendamment des traitements). Les analyses coût-efficacité montrent presque toutes que traiter le VHC est coût-efficace, quel que soit le nouveau de fibrose, avec un QUALY de moins de 50 000$, non seulement par l’amélioration de la morbi-mortalité liée au VHC, mais aussi par une réduction des comorbidités. Les CDC ont calculés que les patients VHC américains avec 15 fois plus de risque de décès que le reste de la population, et une très forte diminution de l’espérance de vie. Chez les diabétiques, le traitement du VHC induit une diminution importante de la morbi-mortalité cardiovasculaire et rénale.
Lorsque l’on compare aux traitements des cancers, on peut être dans des coûts assez proche voire beaucoup plus élevé pour le traitement des cancers du sein métastatiques par exemple. Le traitement des patients infectés par le VIH coûte 325 000$ tout au long de la vie en 2014, et pour le diabète de l’ordre 13 700$ par an, pendant toute la vie également.
Donc par rapport à certaines pathologie dont la morbi-mortalité est élevée, le coût du traitement du VHC n’est pas « si élevé » (NDR : en tous cas considéré comme acceptable par la majorité silencieuse)
Que font les pays : ils négocient ! Soit ils garantissent des volumes d’utilisation contre des réductions de prix (Brésil et Portugal), soient ils font la manche (91 pays les plus pauvres, mais quid des autres ?), soit ils boudent (pas de négociations et pas de traitement en Angleterre), ou les négociations sont réalisées par l’état (Allemagne). Les assureurs américains ont négocié directement avec les compagnies pharmaceutiques, sans que l’on connaisse les prix obtenus in fine, et souvent sur un ou deux traitements seulement pour chaque compagnie, ce qui fait que c’est l’assurance du patient qui décide quel traitement va être prescrit. Et en face, les associations montent au créneau : Médecins du monde à déposé une plainte en février 2015 auprès de l’Agence européenne du médicament pour contester le brevet du Sofosbuvir.
Le nombre très important de patients VHC+ entrant dans le système MEDICARE (qui ne concerne que les plus pauvres des américains) fait que le traitement serait particulièrement coût efficace, notamment s’il est donné avant l’entrée dans le programme.
La concurrence joue son rôle, la première mise en concurrence a fait baisser les prix affichés de 46%. Le coût de 12 semaines de traitement générique par DAA varierait de 78 à 454 $ en fonction des molécules utilisées et de leur nombre (bi, tri ou quadrithérapie augmentant le coût final), tout en sachant qu’avec ces prix, les fabricants de génériques gagneraient encore de l’argent...
En pratique, la question aujourd’hui est de savoir qui décide quand et comment les patients vont être traités : les compagnies d’assurance, l’état, le contribuable, le patient, le médecin, la compagnie pharmaceutique… ? Ou un peu tout le monde…
(NDR : il est un peu dommage que la CROI n'ait pas abordé de façon un peu plus punchy la question éthique du coût des traitements, en faisant intervenir les associations spécialisées qui militent dans le domaine ; les mauvais esprits, dont je suis, renverraient à la page VI du programme qui affiche la liste des sponsors « platinum » de la CROI...).
Mercredi 25 février 2015
Session plénière - matin
La prise en charge pédiatrique reste l’un des parents pauvres de la lutte contre le VIH, et si les stratégies de prévention sont à l’honneur cette année, y compris pour la prévention de la transmission mère-enfant, une fois infectés c’est une autre paire de manche : défaut de diagnostic, retard de traitement, mauvaise intégration dans les circuits de soins, épidémie galopante chez les adolescents… Malgré tout, en 2013 encore 240 000 enfants ont été infectés par le VIH. Cela justifiait largement d’une mise au point pédiatrique dans le cadre d’une session plénière.
Prévenir les infections pédiatriques et prendre en charge les enfants infectés : où en sommes-nous aujourd’hui ? Diana M. Gibb University College London, London, United Kingdom
Si la diminution à zéro de la transmission mère-enfant est quasi acquise dans plusieurs pays d’Europe, on en est encore assez loin dans beaucoup de pays d’Afrique. Tous les indicateurs vont vers un bénéfice de la trithérapie chez la mère et l’option B+ (trithérapie définitive dès le diagnostic chez toute femme enceinte dépistée séropositive) est de mise : en Ouganda, le passage de l’ancien système de monothérapie à l’otion B+ s’est accompagné d’une baisse du taux de transmission de 6% à 2%.
Mais peu d’enfants sont testés, avec globalement 44% de tests réalisés à 2 mois de la naissance dans les PED. Ces résultats peuvent être améliorés par des techniques de rappel par texto (finocchario-Kessler et al., AIDS 2014).
Il est particulièrement important de débuter le traitement le plus tôt possible (exemple extrême du « Mississipi baby », que l’on a cru « guéri » avec un traitement débuté quelques heures après le début de l’infection tant le réservoir viral avait pu être diminué), mais il faut rappeler que 90% des enfants sont actuellement diagnostiqués en dehors du cadre de la prévention de la transmission mère-enfant (NDLR : ce qui peut se traduire en pratique par : trop tard !!!).
Le dépistage périnatal n’est donc pas top…et il ne semble pas correctement au-delà de la période périnatale, le dépistage des enfants étant très insuffisant, y compris dans des pays où la prévalence est très élevée comme le Malawi : même en cas de dénutrition sévère, les enfants sont peu testés et des campagnes doivent être menées pour sensibiliser le personnel soignant.
Concernant la prise en charge pédiatrique, on est face à deux épidémies différentes ; au Nord, très peu de cas, une prise en charge très individualisée et plus de 20 médicaments ; au Sud, une épidémie qui reste massive, une prise en charge très « globale » qui ne peut faire que peu de place à l’individualité, et très peu de traitements disponibles.
La raison de traiter tous les enfants de 2 à 5 ans est programmatique : meilleure rétention pour les enfants traités vs non traités (80 vs 45% en Ouganda), absence de nécessité de CD4 dont la non-disponibilité est souvent une barrière à la mise sous traitement. Mais plusieurs études ont montré que le bénéfice de cette stratégie n’était pas évident : certain pays sont passés comme l’Ouganda, à un traitement systématique de tous les enfants <15 ans.
La formule de traitement idéale n’existe pas actuellement, il faudrait un petit comprimé facile a administrer et ayant bon gout… les sirops actuels ne sont pas très faciles à doser, surtout dans des pays où même trouver un verre est difficile, ou c’est une arrière grand-mère de 65 ans ayant des problèmes de vue qui va être responsable de l’administration du traitement…
Dans l’étude Chapas-2, Cipla a essayé de fabriquer un lopinavir en µgranulés, mais le goût reste détestable et l’on observe une diminution de l’observance à 48 semaines en partie pour ces raisons.
Dans l’étude Chapas-3 en Inde qui teste d4T vs ZDV vs ABC en combinaisons chez les petits enfants, il n’y a pas de différences en terme d’effets secondaires, notamment sur les anémies, qui paraissent plus liées au VIH qu’au traitement (NDR : pour mémoire le tenofovir n’est pas utilisé pour l’instant chez l’enfant compte-tenu des interrogations concernant l’impact potentiel sur la croissance osseuse).
Le dolutegravir pourrait être la solution presque « miracle » : nn comprimé fixe pour les > 12 ans est déjà disponible (ABC-3TC-DLV) et un essai est en cours chez l’enfant (ODISSEY).
La comparaison des essais et cohorte en Afrique, Europe et Asie montre des résultats assez similaire en terme d’échec vers l’âge de 6 ans (de l’ordre de 20%) la grande différence résidant dans le fait qu’en Europe/USA on change le traitement pour une nouvelle ligne alors que les enfants africains sont le plus souvent laissés en échec thérapeutique du fait des insuffisances en tests biologiques (pas de charge virale) et en traitement de seconde ligne administrables.
Pour les adolescents, il faut trouver des solutions plus souples et plus simples. L’essai BREATHER (Penta 16) présenté à cette CROI montre que l’on n’a pas de moins bons résultats en se passant de traitement le week-end…
En résumé :
-
Pour la prévention de la transmission mère enfant, l’élimination est accessible ! Et il faudrait commencer par faire baisser l’incidence chez les jeunes femmes, futures mères, et répondre de façon urgente aux besoins en planification familiale
-
Pour le dépistage des enfants, il faut arriver à aller dans les communautés et dépister les enfants là où ils sont (et ne pas attendre qu’ils arrivent mourant dans les structures de soins)..et une fois dépistés, il faut qu’ils puissent être intégrés au circuit de soins.
-
Concernant le traitement pédiatrique, la constatation est que les résultats sont particulièrement bons pour peu que l’on propose des solutions précoces et pas trop complexes. Mais il faudrait partout disposer de formules combinées dispersibles.
-
Pour les adolescents, il faut aller au delà des simples besoin de traitement pour une prise en charge plus globale et arriver à mieux accompagner le passage Ado/Adultes.
NDR : pour ceux qui sont particulièrement intéressés par le sujet, je conseille de regarder le webcast car Diana Gibb a présenté les schéma de nombreuses études très intéressantes, récentes ou en cours, notamment en Inde, peu connues jusqu’à aujourd’hui.
Communications orales - Mercredi matin
Traitement du sarcome de Kaposi par Pomalidomide chez des patients VIH positifs ou négatifs : un essai de phase I/II - Mark N. Polizzotto (Abs 87)
Il manque dans le traitement du sarcome de Kaposi (KS) une molécule peu toxique qui puisse compléter l’effet des ARV : le pomalidomide est un dérivé de la thalidomide de toxicité moindre et de potentiel d’activité supérieur. Une étude de phase 1/2 a été réalisée pour tester la tolérance et l’effet antitumoral, chez des patients ayant un KS sans localisation pulmonaire ou viscérale (et une infection VIH bien contrôlée pour les sujets VIH+). Il s’agit d’une étude de désescalade de dose (5 puis 3 mg). Vingt deux sujets ont été recrutés dont 7 VIH négatifs. Près de 90% des patients avaient déjà reçu des chimiothérapies antérieures. En dehors de la neutropénie qui est très fréquente (21/22) mais de sévérité modérée et réversible, il n’y a pas d’effets secondaires majeurs, notamment rénaux, thrombotiques et neurologiques qui peuvent être attendus avec cette famille de molécules. La réponse globale paraît très bonne, avec 60% chez les patients VIH+ et 100% chez les VIH-, une réponse dès 8 semaines pour les VIH+ et dès 4 semaines pour les VIH-. Il ne semble pas y avoir de majoration de la toxicité rénale avec le ténofovir. Le suivi biologique montre une forte augmentation des CD4 et des CD8 à S4 et S8, chez les patients VIH+ et VIH-, qui explique probablement une partie de l’effet obtenu, avec une immunmodulation des lymphocytes T.
Modèle pronostique pour les patients porteurs d’un sarcome de Kaposi et traités par ARV seuls en Afrique. Jeffrey Martin (USA/Ouganda) Abs 88
La question qui se pose est de savoir si l’on peut prévoir, en Afrique, quels patients vont aller mieux sous ARV seuls et quels sont ceux qui vont avoir besoin de chimiothérapie pour la prise en charge de leur KS. Cette dernière question est particulièrement importante pour les familles, les chimiothérapies étant couteuses et à la charge du patient ou de sa famille…
Dans un premier temps une étude à randomisé traitement par antiprotéases vs NNRTI à Kampala et n’a pas trouvé de différence entre les deux régimes pour ces patients VIH+ ayant un KS. Ce sont les données des 224 patients de cette étude qui ont été ensuite utilisés pour créer le modèle. Une multitude de paramètres (57 variables) ont été introduits dans un modèle de régression logistique pour arriver in fine à 3 variables significatives prédictives de l’évolution (chimiothérapie ou décès versus les autres) et faciles à collecter:l’index de Karnofski, le nombre de sites anatomiques et le taux d’hémoglobine. Il faut néanmoins noter que ce n’est pas parce que les patients ont un mauvais pronostic que cela signifie que la chimiothérapie leur serait bénéfique… cela nécessite des essais complémentaires, afin de savoir si une approche plus « agressive » est bénéfique pour ces patients ayant le plus mauvais pronostic.
Suivi à un an des femmes VIH+ dépistées pour dysplasies du col utérin par les techniques VIA, cytologie classique et PCR HPV en Afrique du Sud. Cynthia Firnhaber (USA/Afrique du Sud, abs 89)
Le cancer du col représente la cause la plus fréquente de décès par cancer en Afrique (23% des décès par cancer). Les femmes VIH+ sont 3 à 6 fois plus susceptibles de développer un cancer du col. Dans cette étude « Right to care », 1 202 femmes VIH+ (peu immunodéprimées, 87% de contrôle viral du VIH) ont été screenées, avec frottis puis prises en charge avec la technique VIA « see and treat » (les lésions apparaissant anormales après coloration à l’acide acétique sont biopsiées et traitées dans le même geste). Elles ont également bénéficié d’une PCR HPV ; 73% des femmes ont des lésions de haut (33%) ou de bas grade (40%) en cytologie, avec une très bonne corrélation avec le test VIA, et une meilleure sensibilité de la PCR HPV.
Sur les 1 202 femmes, certaines ont été d’emblée référées pour traitement (lésions CIN2+) ou exclues (grossesses, décès…) : 837 ont été suivies et 688 ont pu être revues à 12 mois. 7% avaient des lésions de haut grade, 16% ont acquis une infection HPV, 48% n’ont plus d’HPV. Il existe une progression significative à un an des lésions chez un nombre significatif de femmes, malgré les bons paramètres immunovirologiques, ce qui plaide pour un suivi assez soutenu.
Haut niveau de dysplasie anale de haut grade chez les femmes VIH+ ne rentrant pas dans les critères habituels du dépistage du cancer du canal anal - Fanny Ita-Nagy, USA (Abs 90)
Dans l’état de New York, 877 femmes ont été screenées avec une cytologie anale de façon systématiques, indépendamment des recommandations en cours ; 55% avait des anomalies (≥ ASCUS), 290 on bénéficié d’une anuscopie haute résolution (AHR) et de biopsies. 71% de ces femmes avaient déjà eu des lésions du col, 66% avaient eu des relations anales. Les CD4 état en moyenne de de 584/mm3. Des lésions de haut grade sont détectées chez 28% des patientes biopsiées. Le tabac et les relations anales paraissent un facteur de risque de lésions anales de haut grade. Les conclusions sont qu’un screening élargi permet in fine de traiter des lésions qui seraient passées inaperçues.
Le nouveau Système Xpert-Ultra : une sensibilité égale aux cultures classiques - David Alland , USA, abs 91
Le Système Xpert est très performant pour les tuberculose BK+, un peu moins pour les patients BK- à l’examen direct (une revue Cochrane de 2013 a refait le tour des études consacrées à ce système). Du fait de ces performances limitées chez les patients à charge bactérienne faible, le test a été transformé, afin d’amplifier plusieurs cibles, utilisant une nouvelle technique de PCR nichée. Par ailleurs, la taille de l’échantillon utilisé est passée de 25 à 50 µl pour améliorer la sensibilité. Enfin, les cibles d’identification de la résistance à la rifampicine ont été modifiées. Ceci permet d’augmenter la sensibilité du test sur les échantillons peu riches en BK. Le système Ultra a été testé sur 10 contrôles cultures négatives, avec 100 de spécificité ; pour les BK+, 100% de sensibilité ; pour les BK-, 63% de sensibilité avec l’Xpert classique et 94% avec l’Xpert-Ultra, et tous les tests de résistance à la rifampicine sont concordants, tout en gardant un temps de rendu de résultats identique de 2h environ. Dans les questions : le prix des cartouches va t-il augmenter ? La réponse et qu’il y a un « accord général sur une absence de changement de prix ».
La majorité des cas d’infection tuberculeuses XDR sont de transmission nosocomiale en Afrique du Sud - N. Sarita Shah (Afrique du Sud, Abs 92)
La tuberculose (TB) mulitrésistante (MDR) ou ultra résistante (XDR) est un problème majeur de santé publique en Afrique du Sud, notamment à l’Est du pays. Les facteurs de risque d’acquisition d’une TB-XDR ont été étudiés au Kwazulu Natal entre 2011 et 2013, incluant les parcours des patients, les coordonnées GPS de leur domicile, les traitements antérieurs contre la tuberculose etc…
Une étude génotypique des souches a également été réalisée pour identifier les Cluster.
Résultats : 59% des participants étaient des femmes, 6% étaient des soignants, 77% était infectés par le VIH ; 65% toussaient. Vingt et un pour cent des sujets porteurs de TB-XDR avaient déjà eu un traitement de MDR-TB : c’est le groupe des résistances acquises. Les autres n’avaient pas été antérieurement traités pour une tuberculose : près de 80% ont donc acquis une souche XDR transmise par un autre patient ! 22 clusters ont été identifiés, le plus important étant de 21 patients, le plus petit de 2 patients, mais les souches, même de clusters différents, sont assez proches. Le parcours des patients met en évidence une acquisition importante dans les structures de soins, avec la moitié des 80% n’ayant jamais eu de tuberculose ayant été hospitalisés antérieurement à l’acquisition de l’XDR-TB. L’étude est un peu limitée par les difficultés diagnostiques de la TB-XDR, le fait que tous les cas identifiés n’ont pu être inclus et qu’il y a un biais lié à la survie (seul les survivants sont inclus…).
Il est essentiel en Afrique du Sud d’améliorer l’accueil des patients porteurs de tuberculose dans les structures de santé : isolement, bonne ventilation des lieux etc.. ; doivent être rapidement mises en place, il faut également que les patients soient diagnostiqués et traiter tôt, la charge bactérienne décroissant très rapidement au moment de la mise sous traitement.
Accès au soins après dépistage en Afrique du Sud : étude randomisée contrôlée du rôle des navigateurs de santé - Ingrid V. Bassett, (USA/Afrique du Sud, abs 93)
Cet essai randomisé contrôlé à été mené à Durban : l’idée est de savoir si le fait de faire intervenir un « navigateur », qui va envoyer des SMS et passer des coups de fils au patient après son dépistage, améliore l’intégration à la filière de soins. Les end-points sont la mise sous traitement ARV dans les trois mois, la mortalité et l’observance du traitement de la TB.
6 536 personnes ont été screenés, 4 900 étaient éligibles, 4 903 inclues et 1 899 étaient infectés par le VIH et ont donc été randomisés « Navigateur de soins vs soins standards » ; 1 146 patients étaient éligibles pour un traitement selon les recommandations d’Afrique du Sud, et 28% avaient une tuberculose, ce qui a permis de définir les indicateurs devant être atteint à trois mois.
En intention de traiter, l’intervention du navigateur de santé n’amène pas d’amélioration de la prise en charge : globalement 40% des patients éligibles prennent effectivement un traitement ARV au site de prise en charge désigné trois mois après le dépistage, ou sont sous traitement anti-tuberculose quand ils le nécessitent, quel que soit le bras de randomisation. Mais quand on analyse finement les méthodes, on constate que les navigateurs n’arrivent pas à joindre les patients dans un nombre très élevé de cas. Si on analyse le sous-groupe qui a pu être contacté, on constate de meilleurs résultats dans le groupe de ceux qui sont joignables. Il n’y avait pas dans cette étude, d’incitation financière pour rester joignable ou de fourniture de téléphone portable…
Est-il sans risque d’arrêter le cotrimoxazole (CTX) chez les adultes VIH+ traités par ARV : COSTOP, un essai randomisé de non infériorité - Jonathan B. Levin, Ouganda/UK, Abs 94
La plupart des essais antérieurs, non contrôlés, ont montré une surmortalité et morbidité liée à l’arrêt du CTX, essentiellement liée au paludisme. Mais il n’y avait pas jusqu’à aujourd’hui d’essai contrôlé et randomisé avec placébo.
Cette essai a randomisé 2 180 adultes sous ARV depuis au moins six mois, avec des CD4 > 250, en étudiant deux bras : poursuite du CTX 960 mg vs placebo.
L’analyse en intention de traiter inclue tous les patients ayant reçu au moins un dose et venus à une visite (en pratique, tous les patients sauf 5), et l’analyse per protocole tous les patients prenant au moins 80% de ce qui leur été prescrit.
Les évènements qui pouvaient être prévenus par le CTX sont plus nombreux dans le bras PCB et la non-inferiorité n’a pas pu être démontrée, notamment concernant les pneumonies bactériennes. Il n’y a pas de différence en terme de mortalité ; on retrouve 3.5 x plus de risque de paludisme lorsque le CTX est stoppé (13 ;9% contre 3,9%). Il y a également plus d’hospitalisation dans le groupe PCB, essentiellement liée au paludisme. Les patients rapportent également plus de diarrhées (+80%) dans le bras placebo.
A l’inverse, un peu moins de neutropénie de grade 4 dans le groupe placebo.
En pratique, il faut traiter 113 patients pour éviter un évènement, dans le contexte de cette étude.
Les conclusions de l’étude sont en phase avec les nouvelles recommandations de l’OMS de ne pas arrêter le cotrimoxazole si le patient est fortement exposé en milieu tropical. Dans les zones où il n’y a pas de paludisme, le CTX pourrait probablement être arrêté, le bénéfice ne devenant plus évident.
Et pour terminer la matinée…encore deux petites incursions Ebola.
Impact de l’épidémie à virus Ebola sur la prise en charge des patients VIH+ à Macenta, Guinée forestière, 2014 - David Leuenberger (Guinée, abs 103LB)
Le pic épidémique Ebola en Guinée a été atteint en novembre dans le district de Macenta, avec 80 cas pour 100 000 habitants au pire moment. Le centre médical de Macenta est le seul centre de la région spécialisé dans le VIH (avec la tuberculose et la lèpre). La clinique est restée ouverte pendant toute la période épidémique, mais la fréquentation a chuté de près de 40% par rapport à l’année précédente en avril puis à l’automne ; et les dépistages VIH et tuberculose ont chuté de 46% ; les dépenses des patients à l’hôpital ont chuté de 43% ce qui a mis en en question l’équilibre financier de l’établissement… Le suivi dans le service VIH a chuté de 11%, et en août on constate une nette diminution de la délivrance des ARV, qui a néanmoins été très transitoire ; l’évolution globale de la prise en charge du VIH sur l’année a été de +26%, ce qui est comparable aux années précédantes.
La quantité de perdus de vue n’a pas beaucoup été modifiée (18% en 2014 vs 20% en 2013).
Donc en pratique, c’est plus le dépistage et éventuellement le lien nouveau dépistage-soins qui a souffert, alors que le suivi des patients VIH+ déjà intégrés dans la filière de soins n’a été que peu affecté.
Favipiravir chez les patients atteints d’une maladie à virus Ebola : résultats préliminaires de l’essai JIKI en Guinée. (Denis Malvy, France, abs 103-ALB).
Il a été impossible, dans le contexte socio-culturel dans lequel on se trouvait au moment de la mise en place de l’essai, de mettre en place un essai randomisé dans une pathologie où a la mortalité est de 60% et quand les tests de la molécule ont montré un profil de tolérance acceptable… Un essai de preuve de concept a donc été développé, de phase II, dans 4 sites guinéens au sud du pays où l’épidémie est la plus forte (3) et à Conakry (1). L’objectif principal était la mortalité à J14, avec des objectifs intermédiaires sur la décroissance de charge virale etc..
Au 11 février, 106 patient sont été inclus (difficultés de recrutement liées à la très forte baisse de l’incidence au cours des dernières semaines), le DSMB a approuvé la communication concernant les 80 premiers patients, 69 adultes et 11 enfants. Seules les données des adultes ont été analysées ici.
L’insuffisance rénale paraît un facteur important de pronostic : 52% des patients avaient une IRA, mais les patients traités ayant une valeur de PCR haute (>108) et une IRA meurent dans 100% des cas, contre 7% de ceux qui ont une charge virale basse.
Lorsque l’on compare aux données historiques de mortalité sans traitement, celle-ci paraît un peu moins élevée sous traitement (15% vs 30%, p=0,052) chez les patients ayant une charge virale basse. En pratique, le faripravir paraît donc d’une efficacité au plus modérée, et totalement inefficace quand il est donné tardivement (100% de mortalité).
(NDR : Le fait de présenter à un public de VIH-o-logue les résultats de charge virale Ebola selon une technique qui fait que plus le chiffre est faible, plus la charge virale est élevé, a induit pas mal de confusion dans la salle, et la séance de questions a été cocasse, le public ne comprenant pas pourquoi dans cette étude, plus le chiffre de charge virale était élevé, meilleure était le pronostic… un art de la communication à revoir !!).
Mercredi après midi - Communications orales - Session nouveaux antirétroviraux, stratégie et résistance
Tenofovir Alafenamide (TAF) en monocomprimé pour le traitement du VIH-1 - David Wohl (USA, Abs 113LB)
Le TAF induit une circulation de ténofovir (TFV) diminuée de 90% par rapport à l’administration de fumarate de ténofovir (TDF), le composé actuellement utilisé. Les études 104 et 111 ont randomisé 1:1 des adultes avec une CV> 1000 cop/mL, naïfs d’ARV, sans co-infection hépatique et ayant une clearance > 50 ml/min, pour recevoir du Stribild™ versus le même régime en remplaçant le TFV par du TAF (mono comprimé TAF+FTC+Cobicistat+Elvitegravir). Les résultats à S48 sont présentés : 2 175 sujets ont été screenés, 866/867 ont été randomisés dans chaque bras. L’objectif primaire (CV<50 cop/mL) est atteint pour 92% avec le TAF et 90% avec le TDF, concluant à la non-inferiorité du TAF dans cette combinaison. Les résultats sont identiques quels que soit la CV de base et le niveau de CD4, le sexe, la race…
Les échecs sont rares, 0.8% des patients présentent une résistance à l’échec virologique dans le groupe TAF et 0.6% dans le groupe TDF. Il n’y a pas de différence en terme d’effets secondaires. Huit traitements ont été arrêtés dans le groupe TAF et 13 dans le groupe TDF, pour des raisons très variées et peu liées aux traitements. Il n’y a pas eu de tubulopathie ou d’insuffisance rénale dans aucun des deux bras. L’auteur conclut donc que le TAF est aussi actif que le TDF en association monocomprimé avec FTC, cobicistat et elvitegravir.
(NDR : on pourrait se dire en regardant ces résultats que le TAF n’a pas d’intérêt particulier, au moins à court terme, chez les patients ayant une fonction rénale normale… on attend donc avec impatience la disponibilité du générique du ténofovir pour faire chuter les prix en France !).
Activité antivirale et tolérance d’un inhibiteur de maturation de seconde génération - Max Lataillade (BMS, USA, Abs 114LB)
Les inhibiteurs de maturation agissent très tardivement dans le cycle du VIH, juste avant que la particule virale ne devienne pleinement fonctionnelle. Le composé BMS-955176 inhibe la dernière étape de clivage de la protéase, le produit se couplant de façon forte et réversible à VIH-gag, en restant actif malgré un certain polymorphisme de gag.
L’étude AI468002 teste sur une période courte en monothérapie des doses croissantes, de 5 à 120 mg une fois par jour pendant 10 jours, chez 60 patients dont 92% étaient naïfs d’ARV (donc peu de patients dans chaque groupe de posologies). On retrouve un effet très dose-dépendant, avec peu de différence pour les posologies de 40, 80 et 120 mg. La posologie de 5 mg ne fait pas mieux que le placebo. L’effet est persistant après l’arrêt du traitement, illustrant une bonne efficacité cellulaire, avec une baisse de charge virale d’environ 1.5 log10 à J10. Il n’y pas d’effets secondaires cliniques ou biologiques particuliers mis en évidence dans cette courte étude. (NDR : L’orateur paraissait très heureux d'annoncer qu’il n’y a eu aucun mort dans l’essai… de 10 jours chez 40 patients, ceci, pour lui, illustrant la bonne tolérance du produit…on est pas très rassurés sur les nouveaux critères de bonne tolérance de l’industrie pharmaceutique…).
Traitement ARV précoce et traitement préventif de la tuberculose par INH chez les patients VIH+ africains avec un niveau élevé de CD4 : essai ANRS-Temprano - Christine Danel (France, Abs 115LB)
L’essai a été mené dans 9 centres d’Abidjan, avec une randomisation en 4 bras. Bras 1 et 2 : début des ARV selon les recommandations de l’OMS , sans (bras 1) ou avec (bras 2) INH; bras 3 et 4, début immédiat des ARV à l’inclusion, sans (bras 3) ou avec (bras 4) INH. Les recommandations de l’OMS ayant changé au cours du temps, l’essai s’est adapté à celles-ci (variation du niveau de CD4 de mise sous traitement au fil du temps dans les bras 1 et 2). Le traitement de référence était TDF-FTC-EFV sauf nécessité clinique ou virologique d’avoir recours à une autre combinaison (grossesse, co-infection VIH2…).
Entre 2008 et 2012, 2 076 patients ont été inclus (78% de femmes), et il y a seulement 2.6% de perdus de vue au cours de l’étude. L’objectif principal de l’étude est l’analyse de la morbidité sévère. La diminution de morbidité sévère dans le groupe traitement précoce versus traitement selon les recommandations en cours est de 44%. La combinaison ART précoce + INH est celle qui obtient les meilleurs résultats. L’effet bénéfique du traitement précoce est retrouvé même dans le sous-groupe des patients ayant plus de 500 CD4 (et à un moindre degré pour l’effet positif de l’INH, à la limite de la significativité).
Des 40 souches isolées de TB pendant le suivi, 5 était mono-résistantes à l’INH et 4 résistantes à l’INH et la rifampicine, sans effet du traitement préemptif par INH.
Lire le communiqué de l’ANRS ICI
Dosages pharmacologiques indépendants du moment d’administration et niveau de résistance virale chez les patients ayant des charges virales basses - Alejandro Gonzalez-Serna (Canada, Abs 117)
L’idée de cette étude est de regarder si le dosage des ARV est un prédicteur indépendant d’évolution après la détection d’une première charge virale basse, en combinaison avec la mesure résistance virale, chez 328 patients de la cohorte de Colombie Britannique.
Résultats : La détection d’une résistance lors d’une première charge virale basse est fortement prédictive de l’échec virologique ultérieur, comme on pouvait s’y attendre ; le fait d’avoir des doses infra-thérapeutiques est également prédictif de l’échec virologique ultérieur, défini par un charge virale >1 000 copies/mL (surtout si l’on ne retrouve pas de médicaments du tout…). Le fait d’avoir un taux subthérapeutique est un des meilleurs prédicteurs de l’échec, plus que la présence de résistance. Le seul critère plus prédictif que la concentration sub-thérapeutique est d’avoir une CV « basse » mais proche de 1 000 copies/mL. La combinaison dosage pharmacologique retrouvant un taux sub-thérapeutique et test de résistance retrouvant des résistances amène une meilleure prédictivité de l’échec virologique ultérieur que l’un ou l’autre isolé.
La présence de résistance antérieure à la mise sous traitement précipite le passage à une seconde ligne thérapeutique en Afrique Sub-saharienne - Tamara Sonia Boender (Paser study group, Hollande, Abs 118)
Paser est une cohorte multi pays (6 pays, 13 centres en Afrique Subsaharienne) de patients inclus en 2007-2008 et suivis de façon prospective depuis ; 2 578 patients ont initié un traitement à base de NNRTI, le sérotype prédominant étant de type C. Ces patients ont été étudiés pour la présence de mutations avant traitement, avec le calcul d’un score génotypique. Cinq pour cent des patients présentaient une résistance primaire. Il y a beaucoup plus de switch vers une seconde ligne dans le groupe avec résistance préalable (GSS > 3) mais on ne retrouve pas, par contre, d’impact sur la mortalité et sur les événements Sida. Le fait de disposer de la charge virale permet d’éviter les « switch » injustifiés.
Impact de la résistance croisée au INTI sur les traitements de seconde ligne avec IP et INTI - Nicholas Paton (Essai EARNEST, Singapour, Abs 119)
L’esai EARNEST a été mené en Afrique Subsaharienne (Ouganda, Zimbabwe, Malawi… essais menés dans 14 centres de 6 pays). Après échec virologique, les patients sont randomisés dans trois bras : inhibiteur de protéase (IP) + 2-3 INTI ; IP + Raltegravir (RAL) ; IP + RAL 12 semaines puis IP seul (bras « monothérapie IP »).
Le niveau médian de CD4 à l’échec est de 71/mm3, proche de celui de la mise sous traitement initial, et 42% des patients ont une CV > 100 000 cop/mL.
A 96 semaines le bras monothérapie IP a clairement montré son efficacité moindre et a été stoppé (60% de CV indétectable versus 80-95% dans les autres bras), et à 144 semaines les résultats (IP + 2 à 3 INTI) ou (IP+RAL) sont équivalents. Concernant les données de résistance, 59% des patients n’ont aucun INTI potentiellement actifs quand on analyse leur génotype ; les patients ayant potentiellement aucun INTI actif accompagnant leur IP ont d’aussi bons résultats (89% de CV indétectable à S144) que ceux ayant la bithérapie RAL +IP, alors qu’on s’attendrait a ce qu’ils ne fassent pas mieux que l’IP seul. Le calcul du GSS montre que plus le virus est résistant aux INTI, meilleur est le résultat du bras INTI+IP, ce qui plaiderait pour un effet fitness, même quand on ajuste aux facteur d’observance.
La résistance du VIH-1 au Dolutegravir nécessite de multiples mutations – Wei Juang (Monogram biosciences, Abs 121)
Les premières description de résistances au Doluteragivir (DTG) ont été décrites par J . Eron en 2013, chez 4 patients en échec de raltegravir et traités par DTG.
L’adjonction d’une mutation G140S aux mutations Q148H et N155H induit une forte augmentation de l’IC 50 mais également une décroissance majeure en capacités réplicatives. Les variant s ayant des mutations au codon 143, 148 et 155 ont une sensibilité réduite au DTG. Les virus ayant les profils 148+155 sont moins sensibles au DTG tout en gardant une capacité réplicative, alors que les profils 143+148 ou 143+155 paraissent plus favorables. En présence de DTG, les mutants 148/155 possèdent un avantage réplicatif qui va les amener à prendre le dessus des mutants 143/148.
Mardi 24 février 2015
L’impression globale en lisant le programme de cette 22ème édition est qu’il va y avoir beaucoup de communications particulièrement intéressantes autour de la prévention. PreP (Pre-exposure Prophylaxis, soit Prévention pré-exposition) et TasP (Treatment as Prevention, littéralement « Traitement en guise de Prévention ») sont à l’honneur, et le congrès a donc naturellement débuté par une session d’ouverture consacrée au sujet.
Session plénière
La prévention pré-exposition de l’infection par le VIH : ce que nous savons et ce que nous avons encore à apprendre pour sa mise en place effective – Raphael J. Landovitz - University of California Los Angeles, Los Angeles, CA, US
Après plusieurs années d’essais, la PreP d’aujourd’hui se résume à l’administration de comprimés de TDF/FTC (truvada™), qui semble supérieure au TDF seul, notamment dans les modèles de primates non-humains. La PreP est née de la constatation que la prophylaxie post-exposition n’était vraiment efficace que si on la donnait en même temps que l’exposition (au mieux… ce qui était difficilement concevable). L’étude Iprex a montré une diminution nette (42%) de l’acquisition du VIH lorsque l’on prenait une PreP, chez l’homme, puis dans l’étude FEM-PreP un résultat décevant de seulement 6% d’efficacité chez la femme. Dans l’étude VOICE, avec une application locale, aucun bras ne retrouve d’efficacité quelconque. Ceci peut être en partie expliqué par le fait que la concentration rectale du TDF est 10x à 100x plus élevée qu’au niveau vaginal. Chez l’homme, une prise 7j/7 assure 99% de protection, alors que chez les femmes, le taux de protection varie de 17 à 80% en fonction des études.
La PreP par truvada™ a été agréé aux USA le 16 juillet 2013, et l’une des questions qui se posait était de savoir si le fait de prendre une PreP allait par ailleurs augmenter les prises de risques (principe de « compensation du risque »). Lorsque l’effet de la PreP est modéré, les modèles de risque montrent qu’il existe alors un risque de majoration du nombre de transmission, comme dans FEM-PreP : même si la « compensation du risque » est faible, c’est à dire que l’on augmente pas beaucoup ses pratiques à risque, le fait que le nouvel outil de prévention proposé soit peu efficace va entrainer une majoration des contaminations. Mais dans les études cliniques, c’est plutôt le contraire que l’on observe : le fait d’être intégré dans une étude fait diminuer la prise de risque. A une exception : dans l’étude « Partner in PreP », on observe une augmentation modérée des prises de risques après la publication des résultats et la levée d’aveugle, ce qui laisse à penser que ce phénomène de « compensation du risque » existe bien.
Autre interrogation concernant la PreP : est-elle à même d’amener une augmentation de risque de faire une primo-infection avec un virus résistant aux molécules utilisées dans la PreP : l’acquisition de virus résistant en cours de PreP est un événement manifestement rare, de l’ordre de 0,06% des virus isolés en primo-infection post-PreP quand on cumule les données de plusieurs essais randomisés.
A partir de quand est-on protégé ? Dans un modèle (Sharon M. Seifert et al. CID 2015), la diminution du risque est de 90% après 7 jours d’exposition au TDF/FTC, pour une exposition rectale. Il est probable que pour des rapports vaginaux, cet effet ne soit obtenu qu’après 21 jours du fait des différences de diffusion/concentration de la molécule.
La tolérance long terme est une question importante, mais les données sont pour l’instant rassurantes : sur 5 400 participants aux essais PreP, le taux d’évènements rénaux est de 0,2% (augmentation de la créatinine de grade 2-4), les données sur le risque fracturaire sont également rassurantes (NDR : mais bien évidemment on manque de recul, la plupart des études se déroulant sur des périodes assez courtes : on imagine que les patients les plus à même de profiter d’une PreP partent pour au moins une à deux décennies de traitement).
Comment faciliter l’observance de la PreP, puisque les essais montrent que c’est un des facteurs essentiels de succès ? Les techniques de counseling, d’envoi de texto, de piluliers électroniques etc… sont en cours d’essai. Pour maximiser l’impact de la PreP, les modèles cout-efficacité montrent que la PreP est surtout coût-efficace chez ceux qui sont bien évidemment les plus à risque. Dans Iprex, la Prep n’est pas « efficace » chez les patients qui ont des rapports toujours protégés… puisque même sans PreP, ils ne se contaminent que très peu. Pour mieux préciser ces données, l’étude Iprex-OLE s’est intéressée spécifiquement aux MSM et transgenres : avec 76 % d’observance et une diminution globale des prises de risque (Grant et al. Lancet 2014), on est assez rassuré sur le caractère coût-efficace chez les sujets à très haut risque.
Mais la PreP par TDF/FTC n’est pas très utilisée actuellement aux USA, probablement par impréparation des prescripteurs : les praticiens les plus à même de prescrire la PreP, ceux qui prennent en charge les VIH+, ne les voient pas avant la séroconversion…et les autres sont frileux ! Des efforts de communication sont nécessaires, d’autant plus qu’aux USA, la prise en charge de la PreP est assez complexe, et plusieurs mécanismes se mettent en place, soit via les assureurs privés, soit via les états (NDR : la communication de l’essai Iprex, voir plus bas, va probablement accélérer la disponibilité de la PreP en France, et il va être nécessaire de se poser les mêmes questions concernant les meilleures stratégies de prescription).
Quel futur pour la PreP, quelles sont les alternatives au TDF/FTC ? Pour le maraviroc, un essai est en cours dans cette indication ; les molécules d’action longue sont aussi en cours d’essai (rilpivirine et cabotegravir, essais HPTN 076 et 077). Concernant les modalités d’administration de la PreP, la CROI 2015 sera riche en résultats, avec la communication des résultats des essais Ipergay (Abst 23LB) et HPTN 067 (Abst 977 LB). Un autre essai est en cours chez les MSM (HPTN 073).
L’orateur a terminé son speech en précisant qu’il ne fallait pas de nouveau être du « mauvais côté de l’histoire », rappelant les discours moralisateurs des années 30 qui stigmatisaient le traitement de la syphilis en alléguant que traiter la syphilis était un encouragement à la débauche, et que ce discours est ressorti quelques décennies plus tard au sujet de la contraception orale… il ne faut donc pas le renouveler concernant la PreP !
Communications orales
PROUD : Essai randomisé ouvert pragmatique de PreP - Sheena McCormack, UK abs 23LB
Les essais historiques de PreP ont montré l’efficacité de cette méthode chez les MSM, mais persiste la question de l’augmentation potentielle des prises de risque en matière de rapports sexuels. L’essai PROUD a ainsi randomisé 545 MSM dans 13 cliniques anglaises recevant des MSM. L’inclusion nécessitait d’être VIH-, et d’avoir eu des rapports anaux non protégés dans les 90 jours précédant. La randomisation portait sur la mise en route immédiate ou différée (à 12 mois) de la PreP, les patients étant ainsi leurs propres témoins. Du fait de la démonstration de l’efficacité de la PreP en 2013, le comité de surveillance a demandé à ce que tous les MSM de l’étude se voient proposés la PreP à partir d’octobre 2014, et l’étude a donc été modifiée en conséquence. Trois infections ont été observées dans le groupe PreP immédiate versus 19 dans le groupe PreP différée, soit une réduction de risque de 86%. En parallèle, le nombre d’IST n’est pas différent dans le groupe immédiat et différé (29 vs 27%) ce qui laisse à penser que la PreP n’a pas d’effet négatif sur la protection générale.
PreP à la demande avec TDF-FTC chez les MSM : résultats de l’essai ANRS Ipergay – JM Molina, France, Abst 23 LB
L’essai Ipergay, mené en France avec le soutien de l’ANRS, s’intéresse à la PreP intermittente, pour essayer de répondre à la question à la fois de l’efficacité et de l’observance de la PreP dans des conditions de « vie habituelle ». La particularité de l’essai est d’avoir été conçu avec la communauté MSM française et son soutien actif, afin d’être au plus près des préoccupations de celle-ci ; 445 patients ont été screenés, 414 ont été randomisés, 88% des participants ont complété l’essai.
Les participants (MSM VIH négatifs, ayant eu des rapports non protégés dans les mois précédents l’inclusion) de cet essai contre placebo, en insu et randomisé, devaient prendre 2 cps 24h avant l’acte sexuel potentiel, un comprimé dans les 24h suivantes et un dernier comprimé 48 après l’acte. Il n’y a pas eu de modification dans les pratiques sexuelles et de prévention des participants. La plupart des patients avaient des rapports anaux non protégés fréquents, et plus de 200 IST ont été diagnostiquées chez 140 patients. Seize MSM se sont infectés (ce qui est plus que ce qui avait été calculé initialement), 2 dans le bras TDFT/FTC et 14 dans le bras placebo (incidence de 6 .75 pour 100 personnes/années), soit une réduction relative de 86% ! En moyenne, 4 cps ont été utilisés chaque semaine. Globalement, 28% des rapports n’étaient pas encadrés par de la PreP. Il n’y a pas eu de différence en terme d’effets secondaires entre les deux groupes, notamment sur les effets rénaux. La PreP intermittente montre donc une efficacité tout à fait nette dans une population où le taux d’incidence est extrêmement élevé, et il faut traiter 18 personnes pendant un an pour prévenir un cas, ce qui en santé publique parait un investissment raisonnable.
Le communiqué de l’ANRS sur cet essai peut être téléchargé ici
Quasi-élimination de la transmission du VIH dans un projet combinant PreP et ART - Jared Baeten, USA/Kenya, Abs 24
Développer la protection au sein des couples sérodifférents est actuellement une priorité de l’OMS. Le projet Partners demonstration est une étude ouverte, prospective et interventionnelle, au Kenya et en Ouganda ; les participants ne devaient pas avoir participé aux essais de PreP réalisés antérieurement dans la même région, et devaient être classés à haut risque de transmission selon un score préétabli (jeunes, rapports non protégés etc…). L’intervention consiste à donner un traitement au partenaire qui est infecté, et de donner une PreP au partenaire non-infecté jusqu’à ce que son partenaire infecté ait complété 6 mois de traitement. Si le partenaire séro+ ne débute pas le traitement tout de suite, la PreP est poursuivie jusqu’à ce que ce partenaire ait complété 6 mois de traitement. Compte-tenu des données scientifiques disponibles, il n’était pas éthique de proposer un essai avec placébo, et les données d’incidence attendues (afin de comparer les taux d’incidence avant/après l’intervention) ont été établies à partir de modèle issues d’études de PreP antérieures dans la même zone géographique (comparaison à des données historiques récentes) : 1013 couples ont été inclus à ce jour, soit un suivi de 858 personnes/années (l’étude est toujours en cours). L’adhésion à la PreP et au traitement ARV est élevée (95% pour la PreP et 80% pour le traitement, dont 90% ont une CV indétectable).
A partir de la simulation historique, on attendait 39.7 infections avec une incidence de 5.2 personnes/années en l’absence d’intervention. L’incidence observée avec cette combinaisons PreP/ARV est de 0,2 personnes/années (2 infections) : une réduction de risque de 96% ! Les deux sujets qui se sont contaminés avaient un défaut majeur d’observance, avec des taux de TDF indosables au moment de la primo-infection. On en revient aux constatations antérieures : la PreP fonctionne quand on la prend !
Majorer l’utilisation de la PreP afin d’impacter l’incidence des nouvelles infections à San Francisco - Robert M. Grant, UCSF, USA, Abs 25
La cascade de prévention de San Francisco pourrait paraître exemplaire, avec plus de 90% des personnes infectées diagnostiquées, et plus de 80% d’entre elles prenant ou ayant pris un traitement ARV. L’introduction de la PreP se fait donc dans un contexte particulier, et la question qui est posée est de savoir combien de PreP il faudrait utiliser pour obtenir une diminution de l’incidence. Dans une étude de novembre 2014 auprès d’une clinique recevant des MSM, 16% des MSM avaient déjà utilisé une PreP et 60% souhaitaient fermement une prescription de PreP. Plusieurs surveillances épidémiologiques sont en cours chez des MSM séronégatifs : globalement > 30% des MSM rapportent des rapports anaux non protégés, et 15% rapportent une utilisation de la Prep au moins une fois. Plus la prise de risque est élevée, plus l’utilisation de la PreP est importante. Les calculs montrent donc que 16 089 personnes seraient éligibles pour la PreP à San Francisco. L’introduction de la PreP pourrait faire diminuer l’incidence de 450 cas/an (2011) à 100 cas/an si 15 000 personnes étaient sous PreP, en projetant que ceux qui sont le plus a risque sont les « meilleurs » utilisateurs de la PreP, comme cela a été montré dans l’analyse à long terme de l’essai Iprex-OLE.
Etude de phase III FACTS 001 : application péricoïtale de gel de tenofovir pour la prévention du VIH chez la femme - Helen Rees, South Africa, Abs 26
L’objectif principal de l’étude FACTS 001 est d’étudier l’effet sur l’incidence du VIH chez la femme de l’application d’un gel de TDF à 1%, 12h avant et 12h après un acte sexuel, sans dépasser deux applications/24h.
Près de 4 000 femmes ont été screenées, 2 059 ont été randomisées, 1 032 dans le bras gel-TDF et les autres dans un bras « gel-placébo ». Les données de 2 029 femmes sont in fine analysables. Près de 90% sont célibataires, et 70% ont moins de 25 ans. Comme dans les études antérieures, il n’y a pas de diminution d’incidence dans le bras TDF : 4 pour cent/personnes/années dans chaque bras, sans effet temporel (il n’y a jamais de différence entre les deux bras pendant toute la durée de l’étude). L’observance est de l’ordre de 50-60%, et seulement 13% des femmes avaient une utilisation > 80%. Dans une sous-étude pharmacologique et d’observance, 64% de 214 femmes ont un prélèvement vaginal positif pour le TDF au moins une fois, mais seulement 22% ont des prélèvements positifs systématiquement, et 13% n’ont jamais de détection de TDF dans la muqueuse vaginale. La sous-étude cas-témoin montre que les femmes qui s’infectent utilisent moins le gel, avec une protection dans le cas de bonne utilisation qui serait de 52%. (NDR : cela montre à nouveau que non seulement l’application de gel de TDF en population générale ne fonctionne pas, mais qu’il faut être extrêmement observante pour avoir une protection somme toute moyenne… faut passer à autre chose !)
En vrac...
Dans une étude chez 73 femmes VIH-/HSV2+ (RA Bender-Ignacio et al., USA, abs 27), on compare l’utilisation d’un gel de TDF ou d’un comprimé de TDF, ou les deux (versus placebo) : on observe une diminution de 24% de l’excrétion de HSV ave le TDF ce qui montre son efficacité intrinsèque mais a peu de chance d’avoir une quelconque efficacité clinique (l’acyclovir diminue les récurrences de plus de 80%). Le gel diminue la quantité de virus de 60% mais pas le nombre de récurrences ni de lésions constatées.
Le DMPA, très utilisé en contraception hormonale injectable dans les PED, a été récemment associé dans deux études à une augmentation de risque d’acquisition du VIH de 1.50 et 1.46. Des récentes études ont montré que le DMPA entrainait un risque plus important d’acquisition d’HSV-2 après exposition chez la souris. Cette étude (Mary K. Grabowski, USA/Ouganda, Abs 28) s’intéresse à l’incidence de l’HSV2 chez les femmes sous contraception par DMPA. L’utilisation de la contraception était très « dynamique » avec un usage plutôt intermittent. Moins de 7% des femmes de la cohorte utilisaient de DMPA de façon continue. Chez les femmes utilisant le DMPA de façon continue, l’augmentation de risque d’acquisition d’HSV-2 est de 2.26 (1-4) quel que soit le partenaire, et un risque de 6.23 (1,5-26.3) quand le partenaire est HSV2+ : mais il faut se rappeler que le nombre d’utilisation permanente est très faible : le DMPA pourrait donc augmenter le risque d’acquisition de l’HSV2, et ce risque pourrait être corrélé à la surincidence du VIH (NDR : on reste sur des hypothèses…). En cas d’utilisation intermittente, on ne retrouve pas cet effet de majoration de l’incidence de l’HSV-2.
Les Newyorkais du Bronx (avec également quelques quartiers de la ville de Washington) se demandent comment améliorer la qualité des soins chez leurs patients, et surtout de faire à ce qu’il viennent consulter. L’étude HPTN065- TLC-Plus (Wafaa El-Sadr, USA, Abs 29) étudie le principe est de distribuer un coupon d’achat de 125$ si une visite de contrôle était réalisée dans les trois mois suivant le dépistage positif, ou pour les patients chroniquement infectés, pour assister à la visite suivante. Pour le dépistage initial il n’y a pas d’effet, pas d’augmentation du nombre de visites réalisées lorsqu’un coupon est distribué. Pour les patients en soins, si l’on regarde la proportion de CV indétectable, il existe un petit effet de l’incitation financière, mais il n’est pas majeur : il est un peu plus important pour les petits sites, pour les sites hospitaliers vs communautaires, pour les sites où les CV sont souvent détectables. Il existe également un petit effet sur la continuité des soins, dans les mêmes sites. Les auteurs concluent que l’incitation financière a bien un effet mais qu’il est minime dans le cadre de cette étude.
La circoncision a montré son efficacité pour prévenir l’acquisition du VIH, mais quel est l’effet de celle-ci chez les hommes VIH+ ? Une étude menée en Ouganda (Jordyn L. Manucci, USA/Ouganda, Abs 30) a regarder quelle était la quantité de VIH récupérée au niveau de la muqueuse du gland avant et après circoncision (en lavant la zone de circoncision avec 5 ml de PBS récolté ensuite pour analyse) : chez les hommes non traités, on observe une majoration de l’excrétion de VIH entre J7 et J28, mais l’excrétion après J42 est inférieure a ce qu’elle était avant la circoncision (réduction de 80%). L’excrétion de VIH est par ailleurs très proportionnelle à la charge virale plasmatique, l’effet est moins net chez les hommes traités, mais malgré tout on observe une majoration de l’excrétion à J8 et J14, puis une diminution secondaire. En pratique il est donc important que les rapports soient protégés dans les 4-6 semaines suivant la circoncision, et probablement intégrer un traitement ARV dans cette situation pour ceux qui ne sont pas encore traités.
Symposium "cancer et VIH" - mardi après-midi
Le vieillissement de la population VIH aidant, le sujet des cancers associés au VIH, au même titre que la mortalité cardiovasculaire ou les atteintes cérébrales, est assez présent au cours de cette 22ème CROI.
Cancers associés au VIH : une épidémie mondiale - James J. Goedert National Cancer Institute, Bethesda, MD, US
Les cancers associés au VIH ont très fortement régressés aux USA au cours des dernières années. Le sarcome de Kaposi en particulier s’est stabilisé depuis le début des années 2000 à un taux relativement faible. En Afrique, la situation est différente, le SK est particulièrement présent en Afrique de l’Est, avec un pic au Zimbabwe, Swaziland, à moindre degré eau Mozambique, alors que l’Afrique du Sud est proportionnellement relativement épargnée. Concernant les lymphomes, ils paraissent être proportionnellement moins fréquents en Afrique qu’en Europe et en Amérique du Nord. Le cancer du col a une géographie particulière : en Afrique de l’Est et Centrale, mais également en Afrique de l’Ouest, devenant le cancer n°1 chez les femme en Afrique.
Concernant les cancers non associés au VIH aux USA, le VIH représente environ 20% des cancers diagnostiqués (Robbins JNCI 2015). Pour certains cancers , la part du VIH est majeure, comme pour le cancer anal où la majorité des diagnostics sont réalisés chez des VIH+, notamment chez les sujets vieillissant.
Pour le cancer du poumon, la diminution de l’incidence est plus rapide dans la population VIH que dans la population non-VIH, probablement liée à l’effet des ARV, en plus des programmes de cessation du tabac. Le risque relatif reste tout de même de 2,5x pour le VIH, avec probablement au moins 2/3 de ce sur-risque lié à la proportion plus importante de fumeurs. Pour le cancer du foie, on observe une augmentation de l’incidence très largement liée à la co-infection VHC non traitée. En Europe, la mortalité liée aux cancers non-VIH augmente, de même que dans les études françaises mortalité 2000/2005/2010, alors que la mortalité liée aux cancers VIH diminue.
Quelles sont les priorités : traités plus précocement le VIH, vaccins anti-HPV et screening de l’HPV, arrêt du tabac, vaccination anti-VHB et traitement du VHC.
Oncogénèse virale : une évolution des concepts - Shannon C. Kenney - University of Wisconsin, Madison, WI, US
Les virus sont la cause de 15% des cancers, mais la plupart des personnes porteuses de virus oncogènes ne développeront jamais de cancer. Les mécanimes qui permettent au virus de « générer » un cancer sont assez variés, et ont été bien étudiés dans le années 2000 (Hanahan and Weinberg, Cell, 2011, Mesri et al. Cell Host Microbe 2014).
Pourquoi les HPV oncogènes génèrent des cancers ? La protéine E6 de l’HPV inhibe la production de P53, qui est un agent absolument essentiel de la régulation/réparation cellulaire. Pour l’EBV et le KSV, les choses sont un peu plus complexes (NDR : et je renvoie les passionnés au webcast car cela était un peu difficile à suivre).
Lymphomes et VIH, challenges et avancées - Ariela Noy- Memorial Sloan Kettering Cancer Center, New York, NY, US
Dans toutes les études portant sur lymphomes et VIH, il y a une relation nette entre le niveau de CD4 et la survie. Le niveau de CD4 influence le type de lymphome qui émerge, les lymphomes primaires du SNC et les lymphomes des séreuses étant ceux qui émergent avec les niveaux de CD4 les plus bas et dont l’incidence est en forte diminution du fait de l’amélioration immunologique globale apportée par les traitements antiviraux. Avec l’arrivée des traitements antirétroviraux efficaces, la chimiothérapie a également évoluée, allant vers des traitements plus agressifs (EPOCH). Mais même avec ces traitements très puissants, les patients ayant des CD4<100/mm3 ont des pronostics de survie beaucoup moins bons.
Le rituximab est un anti-CD20 ayant une synergie avec les chimiothérapies et qui a fortement changé le pronostic des lymphomes au cours des dernières années pour les sujets VIH-, mais son caractère immunosuppresseur laissait à penser qu’il pouvait exister un risque majoré chez le patients VIH+ déjà immunodéprimés. Plusieurs études ont été réalisées dans les années 2 000 et montrent la bonne tolérance et efficacité chez les patients VIH+. Dans un essai où certains patients avaient des CD4< 50, la mortalité liée aux infections chez ceux-ci a été très importante, et plaide pour ne plus arrêter les traitements antirétroviraux au cours des périodes de chimiothérapie.
Les lymphomes de Hodgkin se développent chez des patients ayant une immunité « intermédiaire » (plutôt entre 150 et 300 CD4). Les patients en échec de premières chimiothérapies ont habituellement moins de 20% de bonne réponse à une troisièmèe ligne, mais de nouvelles thérapeutiques sont en cours de développement : le Brentuximab Vedotin est un anti-CD30 combiné. Un essai en cours montre pour l’instant d’excellent résultats.
Enfin en cas d’échec des chimiothérapies, la transplantation médullaire reste possible, avec des résultats qui ne sont pas différents entre VIH+ et VIH-. Dans l’essai GICAT (2009), la moitié des 50 patients screenés pour transplantation médullaire pour lymphome réfractaire ont finalement été guéris. Il faut néanmoins noter que dans ces études les patients sont assez sévèrement sélectionnés, avec des facteurs plutôt favorables concernant leur infection VIH.
Enfin des essais sont en cours de construction pour associer transplantation médullaire chez des patients la nécessitant, et chez qui on associera un vecteur viral tendant à modifier le récepteur CCR5, afin d’envisager d’arrêter les ARV après la transplantation.
Les cancers liés au VIH dans les pays en développement : une double charge - Jackson Orem- Uganda Cancer Institute, Kampala, Uganda
Il n'existe malheureusement que peu de données épidémiologiques sur les cancers en Afrique, ce qui limite considérablement les possibilités d’études ; le registre de Kampala montre actuellement une augmentation des cancers liés au VIH, notamment les LMNH, avec néanmoins une petite diminution du KS chez les hommes. Une étude récente montre que pour chaque augmentation de 10% de la couverture ARV, l’incidence du KS diminue de 5%, mais qu’en parallèle il existe une augmentation de 6% des LMNH (I. Mutyaba, sous presse JAIDS). Les données des registres de Kampala (Afrique de l’Est) et d’Abuja (Nigeria, Afrique de l’Ouest/centrale) sont très différentes, sans que l’on sache si cela est lié à une différence épidémiologique ou de recueil de données.
La mortalité des cancers chez les patients VIH+ paraît plus importante que celle des patients VIH- dans la cohorte de Kampala, avec un sur-risque global de mortalité de 2.26. Le retard diagnostique est un élément essentiel, et a été corrélé dans certaines études à la consultation de praticiens traditionnels. Mais même lorsque les patients arrivent tôt, il existe de nombreux défis : accès au traitement anticancéreux, impossibilité de monitorer les effets secondaires etc… Un essai est en cours (ACTG/AMC A5263/AMC 066) teste trois stratégies de chimiothérapies associé aux ARV dans les Kaposi avancés. Un essai de traitement par voie orale a été mené dans les années 2000, avec une réponse globale « satisfaisante » de 24% de survie prolongée…
Pour avancer, il est nécessaire que les PED disposent à la fois d’infrastructures de qualité, mais également d’équipes locales formées internationalement qui puissent s’investir dans la recherche contre le cancer.
Session spéciale qui n’a rien à voir : Répondre au défi du virus Ebola - Mardi soir
Kevin de Cock, en introduction de cette session spéciale, a insisté sur le fait qu’il était difficile de faire l’impasse sur cette pathologie, tant les données épidémiques pouvaient se rapprocher du VIH, mais aussi par l’importance de l’impact d’Ebola sur la qualité des soins aux personnes infectées par le VIH.
Gilles Van Cutsen (MSF), a présenté l’expérience de MSF au cours de l’épidémie, tout en précisant qu’il se sentait plus à l’aise au fond de la forêt du Liberia que devant 4 000 chercheurs du VIH…
Pour résumer très brièvement le virus, il existe 5 espèces d’Ebola de virulence et d’expression clinique variable, avec une incubation de 2-21 jours, une progression clinique en 4 phases, une mortalité de 30-90% et une transmission essentiellement interhumaine.
L’épidémie actuelle est complétement différente des épidémies antérieures : celles-ci étaient le plus souvent rurales, auto-limitées et de durées courtes. Depuis la description des premières épidémies de fièvre hémorragique, l’expérience de MSF a débuté essentiellement dans le contrôle épidémique, puis dans la protection des travailleurs de santé, et plus récemment dans les soins directs aux patients.
L’épidémie actuelle a débuté par le cas d’un enfant de 3 ans probablement infecté par une chauve-souris à Guéckédou en Guinée ; beaucoup des membres de sa famille sont décédés, puis la maladie s’est propagée rapidement pour parcourir plus de 500 km vers Conakry en quelques semaines. MSF et le ministère de la Santé ont été avertis le 10 et le 12 mars, et la maladie s’est propagée dans les pays frontaliers, avec une explosion en août/septembre à Monrovia, puis une diffusion vers la Sierra Leone et la même explosion citadine à Freetown. L’épidémie a évolué en trois phases, où chaque fois elle aurait pu être arrêtée si la réponse avait été appropriée. En parallèle, l’arrivée d’Ebola à Lagos a été vite enrayée, de la même façon au Mali et au Sénégal.
Les 6 piliers de la réponse sont connus : mobilisation, information de la communauté et distribution de kits de protection, identification des cas et traçabilité des contacts, transport sécurisé des patients, management et isolement des patients, enterrement sécurisé.
Actuellement, la réponse de MSF consiste en la mobilisation sur le terrain de 4 400 personnes, 325 internationales et 4 150 nationaux.
La traçabilité des contacts a été particulièrement bonne au Liberia et explique probablement les bons résultats actuels, alors qu’elle a été mauvaise en Guinée et inconnue en Sierra Leone. Le plus grand camps de traitement d’Ebola jamais construit a été mis en place à Monrovia, et n’accueille aujourd’hui plus aucun patient, grâce très probablement à une réponse efficace du Liberia. Le responsable des programmes de lutte contre l’Ebola au Liberia pense qu’une partie de cette « bonne réponse » est liée au fait que les autorités du pays ont pris le leadership de la réponse, et notamment pour la formation des personnels de santé.
Les taux de transmission sont particulièrement élevés pour les patients qui n’ont pas survécu, avec un risque très importants en fin de maladie (et après…).
La mortalité est liée en partie à la charge virale élevée, et on ne comprend pas pourquoi pas les patients arrivant le plus tard dans le temps on des charges virales moins élevées : est-ce lié à une évolution virale, ou au fait que les personnes font plus attention et ont donc des inocula moins élevés. Les recherches de MSF ont permis d’identifier par hasard un cas d’Ebola à charge virale très élevée et sans aucun symptôme dans les 72h ayant suivi le prélèvement biologique (une femme venue accoucher au centre Ebola car on en voulait nulle part, et qui a été symptomatique après la 72ème heure).
La prise en charge d’un corps mobilise six personnes pendant 6 heures, et c’est un des éléments les plus consommateurs de ressources humaines dans l’épidémie.
Dès Mars MSF avait tiré l’alarme en signalant que l’épidémie était inhabituellement importante en Guinée, en avril l’OMS parle d’une « épidémie relativement limitée »… on connaît la suite. La diminution importante de l’incidence doit permettre d’envisager la suite…et prendre les mesures qui permettraient d’éviter une nouvelle crise du même type ; 500 soignants sont décédés au cours de l’épidémie…
H. Clifford Lane (NIH, USA) a fait un état des lieux des traitements et vaccins possibles dans le domaine d’Ebola. L’immunité post-Ebola semble exister mais n’a pas été réellement démontrée chez l’Homme.
Côté vaccination : un vaccin recombinant VSV et un vaccin recombinant chimpanzé adénovirus 3 sont au point. Ces deux vaccins induisent globalement la même réponse Ac, et ils sont en cours de test au Liberia (Vaccin 1 vs 2 vs placébo) dans le cadre de l’essai PREVAIL.
D’autres candidats vaccins sont en cours d’évaluation, à un stade moins évolué.
Concernant les traitements : le caractère explosif de la maladie permet de proposer la diminution de la mortalité comme objectif primaire dans les études d’efficacité. Plusieurs cibles ont été isolées sur le virus, et 4 traitements sont actuellement « prêts » pour être testés. Le ZMapp est une combinaison de 4 protéines, testé avec une efficacité de 100% chez les primates non humains. Dix cas ont été pris en charge aux USA, et tous ont été traités (2 décès), avec différentes thérapeutiques expérimentales (brincidovofir, plasma de convalescent, TKM-Ebola et ZMapp). Certains patients ont développé après la maladie une élévation inhabituelle des enzymes hépatiques, qui est probablement a rapporter à la toxicité de certains traitements.
La mortalité spontanée importante de la maladie fait que la taille des essais peut être très limitée : si 12 patients sont randomisés et que 6 décèdent dans le bras placébo et 6 survivent dans le bras traitement, la significativité statistique est atteinte avec seulement 12 patients…
Mais il y a un certain nombre de challenges : la diminution importante de la mortalité spontanée au cours du temps n’est pas bien expliquée et difficile à modéliser ; la volonté de faire quelque chose à tout prix n’est pas le meilleur environnement scientifique pour mener des études ; l’environnement de recherche n’est pas particulièrement favorable, avec beaucoup d’intervenants dans un environnement difficile.
De la même façon que la réponse sur le terrain a été lente, la réponse scientifique a été tardive, et les chercheurs actuellement ne cherchent plus les vaccins ou traitement, mais les patients pour les tester, qui sont devenus trop rares pour que les essais puissent être menés, même si les effectifs pour mener les essais ne doivent pas être très importants.
JF Delfraissy est intervenu pour dire que la réponse française avait également été assez tardive (il a été nommé coordonnateur pour la réponse Ebola en octobre…) ; les questions de recherche n’ont pas été mises de côté, avec le début de recherches vaccinales, thérapeutique, mais que les recherches dans le domaine social et comportemental sont également importantes ; or paradoxalement, la communauté de ces chercheurs n’est pas très mobilisée…
Lundi 23 février 2015 - Session "Young Investigators Awards"
Vaccins : Galit Alter, Ragon Institute of MGH, MIT and Harvard, Cambridge, MA, US
Comme cela a été montré dans des travaux antérieurs, le réservoir se constituant très rapidement, un vaccin efficace doit pouvoir supprimer tout processus viral dans les 48h suivant le comptage ; deux options se profilent à l’horrizon :
1. Bloquer l’infection : le principe des Ac neutralisants : 30% environ des patients développent des Ac neutralisants dans les 2-3 ans suivant l’infection. Si l’organisme peut le faire, il n’y a pas de raisons qu’un vaccin ne puisse pas le reproduire. Des équipes ont créé une cartographie des zones antigéniques contre lesquelles pourraient être développés des ac neutralisants et ces voies restent à développer.
2. Tuer vite au site de l’infection en induisant la production d’Ac : comment développer des cellules B compétentes pour produire des Ac neutralisants ? Les cellules B sont sous le contrôle, pour la production de ces Ac, de cellules T effectrices spécifiques, et la recherche s’intéresse actuellement particulièrement à ces interactions T-B. Dans un modèle de vaccin HSV animal, certaines équipes développent des techniques « Prime and Pull », en proposant dans un premier temps un vaccin classique (Prime), puis une application vaginale de chemokines qui « attire » les Ac au niveau vaginal (Pull), induisant une protection locale de longue durée.
Donc en pratique, deux voies de recherche : induire des Ac neutralisants ou augmenter la réponse CTL au site de l’infection. Il faut bien garder en mémoire que la réponse que l’on souhaite induire doit être extrêmement rapide : le vaccin doit être plus rapide que la réponse immune naturelle… il faut donc faire mieux que la nature…
A la question de savoir à quelle distance du développement d’un vaccin efficace l’on se situait, l’oratrice a préféré sortir son joker…
Et un jeune investigateur ne s’est pas privé de faire remarquer que finalement, depuis 10 ans, les concepts n’avaient pas trop bougés…et que le vaccin n’était toujours pas là !
Modèles animaux pour le développement des outils de prévention et de traitement Guido Silvestri Emory University, Decatur, GA, US
Les modèles les plus utilisés sont des singes de type macaque ou apparentés qui, quand on les infecte avec le SIV, vont développer un sida. Avantages et inconvénients : les modèles de primates non humains sont les plus proches de l’Homme ; ils sont néanmoins chers, il manque une ressource centralisée de macaques infectés qui pourraient être partagée par l’ensemble des chercheurs, et malgré tout, il existe des différences entre l’Homme et le Macaque et entre le VIH et le SIV !
Les modèles de souris humanisées sont également très intéressants, relativement peu cher et accessibles, ils peuvent être modifiés génétiquement « à la demande », et autorisent l’utilisation de virus humain sur des cellules « humaines ». Mais ces souris ne se reproduisent pas et sont donc un peu moins simple à produire, et il leur manque une structure lymphoïde fonctionnelle.
Qu’amène l’utilisation de ces modèles à la recherche ? En prévention dans les modèles de primates non humains, côté vaccins, plusieurs études montrent que les Ac neutralisants sont efficaces dans les modèles de primates non humain (Gardner et al., Nature 2015 – Hansen et al., Nature 2013). Côté traitement antirétroviral, les récentes études avec des anti-intégrases à action longue comme le cabotegravir montrent un excellent niveau de protection de femelles macaques infectées par voie vaginale. En thérapeutique, l’identité, la dose et la voie d’administration du virus pour les études est connues ; on contrôle très bien les paramètres temporels (moment de l’infection etc…), qui sont des choses qui sont mal maitrisées lorsqu’on essaie de les étudier chez l’Homme. Ainsi il est possible de modéliser assez facilement les différentes stratégies que l’on souhaite appliquer. Par exemple, on montre sur un modèle de macaque chez qui l’infection est contrôlée suite à un traitement antiviral, que l’adjonction d’un Ac anti-CD8 induit un rebond de réplication virale, ce qui illustre bien que le contrôle antiviral est généré par l’immunité propre de l’animal. Les modèles animaux permettent également de tester des traitements plus agressifs comme la thérapie génique, pour laquelle il n’est pas envisageable aujourd’hui de faire des essais chez l’Homme sans passer par des modèles animaux. Une fois le modèle établi, de multiples interventions sont possibles,
Les deux modèles animaux (primates non humains et souris humanisées) sont complémentaires et une exploitation transversale pourrait se développer, ce qui n’est pas encore vraiment le cas.
Il faut essayer d’améliorer ces modèles continuellement, tout en continuant à les utiliser en recherche.
Prévention du VIH 2.0 : What's next ? Susan P. Buchbinder San Francisco Department of Public Health, San Francisco, CA, US
La prévention 2.0 s’articule autour de ces trois piliers : la circoncision, le TasP (traitement comme prévention), la PrEP (Prévention pré-exposition), et trois questions se posent : I/ comment applique t’on aujourd’hui les connaissances que l’on a dans le domaine de la PrEP, du TasP ou de la combinaison des deux ? II/ comment fait-on avec les modèles plus anciens de prévention (essentiellement le préservatif) ? III/ comment sélectionner les populations les plus à même de bénéficier des nouvelles méthodes d’intervention.
Circoncision : on savait la circoncision rapidement efficace, et les analyses plus récentes montrent une efficacité persistante de 58% six ans après le geste (Metha et al., NEJM 2013).
PrEP : une meta-analyse récente (Jiang, PlosOne 2014) met particulièrement en lumière la donnée essentielle de l’adhésion au traitement, avec une efficacité très proportionnelle à l’observance. (www.avac.org). La PrEP intermittente est à l’honneur lors de cette CROI et nous y reviendrons à l’occasion de plusieurs communications. Il y a plusieurs façon de voir la PrEP médicamenteuse : permanente (comme dans les essai CAPRISA), intermittente centrée sur l’acte sexuel (comme dans l’essai IperGay dont les résultats seront présentés demain), intermittente mais renforcée en post-exposition, ou transitoire sur des périodes longues de plus forte exposition.
TasP : les données sont assez « stables », avec une efficacité > 96% dans la plupart des essais ou cohortes en cours.
Le préservatif reste une méthode dont l’emploi reste difficile : en condition idéale, 3% de grossesses la première année (correspondant aux glissements ou ruptures), en utilisation standardisée (donc avec quelques oublis…), 14% de grossesses…
Quelles sont les populations les plus à même d’être ciblées : les jeunes filles d’Afrique Australe sont le principal moteur de la dynamique d’incidence à l’échelle mondiale. Aux USA, la disparité raciale est majeure chez les MSM, ou 16% des infectés noirs ont une CV indétectable, contre 34% (ce qui n’est pas encore génial…) des MSM blancs.
Des modèles d’intervention à domicile ont montré qu’il était parfaitement possible de tester jusqu’à 98% d’une population cible, dont 17% des tests s’avèrent positifs et dont plus de 40 % des positifs ne connaissaient pas leur statut sérologique. La liaison vers le soin est bonne dans les études qui l’ont analysée, sous réserve que les centres de prise en charge ne soient pas trop distants des domiciles. Une étude récente au Kenya retrouve des résultats similaires (Becky L Genber et al., Lancet HIV, Jan 2015).
Pathogénie des complications du VIH Peter W. Hunt University of California San Francisco, San Francisco, CA, US
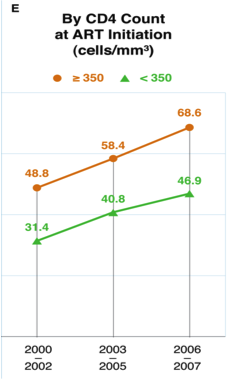
L’espérance de vie s’améliore, mais un fossé persiste, notamment chez les patients dont le traitement antirétroviral a été débuté tardivement (Samji et al., plos One 2013, cf. figure montrant l’espérance de vie moyenne à 20 ans en fonction du niveau de CD4 à l’initiation et de la période de début de traitement). Bien évidemment, le nombre de comorbidités augmente avec l’âge, et devrait être un problème à long terme non seulement dans les pays industrialisés mais également dans les PED.
Si l’on se base sur les primates non humains, les singes infectés par le SIV qui ne développent pas de Sida n’ont pas non plus d’activation immune, or cette réponse inflammatoire est un déterminant majeur du vieillissement. Des marqueurs indirects de l’inflammation sont très prédictifs de la mortalité chez les patients infectés par le VIH (comme l’IL-6), avec notamment une majoration de l’inflammation artérielle ; l’inflammation chronique peut également entrainer une fibrose du tissu lymphoïde, etc…
Que peut-on faire ?
La mise sous traitement précoce, même si elle ne ramène pas le niveau inflammatoire à la normale comparé à des sujets non-infectés par le VIH, amène une diminution rapide de l’inflammation résiduelle (Jain et al. CID 2013). Mais qu’est ce qui cause la persistance de l’inflammation chronique sous traitement ? Est-ce la réplication virale résiduelle de bas niveau, qui reflète essentiellement le relargage sans réplication productive ? Ce n’est pas une évidence, et d’autres mécanismes doivent être recherchés. Dans un modèle d’infection par le CMV, le blocage de la réplication par le valganciclovir diminue l’inflammation chronique chez les patients VIH+, alors que le valacyclovir n’a pas cet effet… La translocation bactérienne, consécutive à l’atteinte massive de l’immunité du tube digestif au moment de la primo-infection, est également une cause probable d’inflammation chronique résiduelle. Les marqueurs d’activation immune sont assez nettement corrélés à la mortalité dans l’infection par le VIH (Hunt et al. JID 2014). Il semble indispensable de disposer de nouvelles techniques permettant de maitriser les sources d’inflammation comme la translocation bactérienne. Et une question non résolue est de savoir si diminuer les paramètres inflammatoires amènerait une amélioration de la morbidité et de la mortalité.
La recherche d’un traitement radical du VIH, un défi de la rétrovirologie. – John Coffin, Tufts University.
La décroissance de la charge virale sous traitement se fait globalement en 4 phases (de t ½ de 1,5 jours, 28 jours, 273 jours et l’infini). La décroissance du réservoir est également rapide mais se limite à un facteur 10 (contre un facteur 10 000 pour l’ARN) et au delà de 20 jours, cette décroissance est lente ou inexistante. Le réservoir est la source de la remultiplication après une suppression virale complète, lorsque le traitement est interrompu. Il n’est pas lié à une réplication persistante mais à des cellules de longue durée de vie ; il représente une fraction minimale du DNA total des cellules infectées (<1%).
Des provirus intacts et latents sont présents dans un faible nombre de cellules : on passe de 1011 CD4+ totaux à 105 cellules ayant un ADN proviral susceptible de se multiplier à nouveau ; on ne sait pas exactement aujourd’hui quelles sont ces cellules hébergeant l’ADN proviral fonctionnel (lymphocytes, macrophages…). Les ARV bloquent l’infection et la formation de nouveaux provirus, mais n’ont aucun effet sur les cellules où cet ADN proviral viable est déjà intégré. Par ailleurs, des populations clonales peuvent apparaître, liées à la division des cellules hébergeant l’ADN proviral. Donc, même si certains clones sont amenés à disparaître du fait de la mort de certaines cellules hébergeant chroniquement un ADN proviral, ils pourraient être compensés par l’expansion clonale d’autres cellules.
Pour espérer obtenir une guérison, il faudrait probablement arriver à diminuer le réservoir de façon massive ; cette diminution quantitative a été modélisée dans certains travaux (Hill et al., PNAS 2014), et les résultats récent autour de deux patients greffés medullaires et le bébé du Mississipi montrent que même quand on « descend » le réservoir à un niveau extrêmement bas, la récidive est de mise… sauf pour le patient de Berlin, où outre la diminution majeure du réservoir via la greffe médullaire, on a mis en place un mécanisme d’interdiction de ré-entrée via une moëlle au récepteur CCR5 naturellement muté en Δ32/Δ32.
Aujourd’hui, on ne connait pas la bonne stratégie pour « frapper et tuer » (shock and kill), qui permette de réactiver les cellules afin de faire exprimer l’ADN proviral puis d’éliminer cet ADN et ces cellules définitivement.
|
